При травме спинного мозга на шейном уровне описано развитие гемодинамических и дыхательных нарушений [1,2,3,4,5,6,14,18], выраженность которых зависит от тяжести травмы. Гемодинамические нарушения включают развитие брадикардии и других вариантов аритмий, артериальной гипотензии, вследствие снижения сосудистого тонуса и сердечного выброса, вплоть до развития шока и асистолии [8,9,12,15]. Семиотика дыхательных нарушений заключается в снижении жизненной и остаточной емкости легких, нарушении регуляции внешнего дыхания, ателектазировании легочной ткани, изменении проницаемости легочных капилляров, пневмонии [7,9,11,13,18]. Это приводит к развитию дыхательной недостаточности вследствие острого повреждения легких.Теоретически развитие выраженных нарушений сердечно-сосудистой и дыхательной систем возможно в практике спинальной нейрохирургии в периоперационном периоде, в частности, при удалении опухолей спинного мозга на шейном уровне. Поиск литературы по этой тематике в электронной системе PubMed с использованием ключевых слов - спинальная нейрохирургия, опухоль спинного мозга, спинальный шок, нейрогенный шок, повреждение спинного мозга - позволил найти всего две работы [5,18]. Это клинические наблюдения из практики спинальной нейрохирургии у пациентов взрослого возраста. Мы приводим клиническое наблюдение пациента детского возраста, у которого при удалении интрамедуллярной опухоли спинного мозга развилась устойчивая артериальная гипотензия и острое повреждение легких.
Клиническое наблюдение
Пациент П., 14 лет поступил в Институт с диагнозом интрамедуллярная опухоль краниоцервикального перехода (С1 – С3). Опухоль верифицирована при МРТ – исследовании (рисунок 1). Пациент предъявлял жалобы на слабость в руках и ногах, затруднение при глотании и головные боли.В неврологическом статусе определяющим являлся стволовый синдром (тетрапарез до 4 баллов, расстройства глотания). На глазном дне были выявлены начальные признаки внутричерепной гипертензии. Показания к оперативному лечению опухоли были определены исходя из клинической картины заболевания и данных МРТ - исследования.Операция производилась под общей анестезией. Вводный наркоз осуществлен тиопенталом-натрия (250 мг) и фентанилом (0,1 мг). Произведена оротрахеальная интубация трахеи трубкой №7 на фоне миорелаксации листеноном (100 мг) после предварительного внутривенного введения субапнойной дозы недеполяризующего миорелаксанта (пипекурония бромида 1 мг). Полная доза антидеполяризующих миорелаксантов не использовалась, поскольку проводился интраоперационный электрофизиологический миографический мониторинг.
Поддержание анестезии осуществлялось пропофолом и фентанилом. Параметры мониторинга во время операции включали в себя ЭКГ, пульсовую оксиметрию (SpO2), капнографию (EtCO2), артериальное давление (АД) прямым методом через артериальный катетер в левой лучевой артерии. Контролировали диурез и газовый состав артериальной крови.Операция проводилась в положении сидя. Из линейного разреза кожи по средней линии произведено скелетирование остистых отростков и дужек С1-3 позвонков. Выполнена С1-3 ламинэктомия и срединная субокципитальная краниотомия. ТМО вскрыта по средней линии вдоль дурального мешка + Y-образно в ЗЧЯ. Область цервико-медуллярного перехода сильно деформирована и выбухает в рану, миндалики мозжечка сильно приподняты. "Раздутость" и напряжение спинного мозга прослеживались до уровня C3 позвонка. В верхних отделах (C2-C1) опухоль выходила субпиально по средней линии. Отмечены реактивные изменения на твердой мозговой и арахноидальной оболочке в виду их утолщения и отложения кальция. Произведено рассечение арахноидальной и мягкой оболочки, они взяты на держалки, и после срединной миелотомии на всем протяжении доступа была обнажена опухолевая ткань. Опухоль серо-розового цвета, плотная, местами очень плотная, умеренно кровоснабжаемая, с многочисленными кистами в ее строме, без плоскости диссекции с веществом спинного мозга. Удаление начато с каудального полюса опухоли и проводилось путем внутренней декомпрессии с помощью ультразвукового аспиратора на всем протяжении в пределах "зоны инфильтрации" и под контролем начала снижения амплитуды двигательных вызванных потенциалов. На основании визуального контроля в ходе операции, опухоль удалена субтотально, однако, послеоперационный контроль выявил тотальное удаление опухоли. (Рисунок 2). Появилась отчетливая пульсация мозга, ликвороток по субарахноидальному пространству, открылись обширные ростральные полости. Дно 4-го желудочка приняло нормальные очертания. Зашивание твердой мозговой оболочки проведено с использованием Goretex. Затылочный лоскут уложен на место и фиксирован узловыми шелковыми швами.
Удаление опухоли сопровождалось эпизодами десатурации (до 85 – 87%) и гемодинамическими реакциями, проявлявшимися выраженной артериальной гипотензией (до 40/0 мм.рт.ст. общей длительностью 15 минут) и тахикардией. Это требовало инфузии симпатомиметических препаратов, коррекции параметров ИВЛ с увеличением фракции кислорода до 80% и положительного давления в конце выдоха до 6 – 8 см водного столба. В конце операции, при манипуляции в ложе удаленной опухоли, артериальная гипотензия приобрела устойчивый характер и была резистентна к увеличению темпа и объема внутривенной инфузии. Применение дофамина в дозе 9 – 11 мкг/кг/мин позволило стабилизировать АД на уровне 90/45 – 95/45 мм.рт.ст. Вновь развилась десатурация до 85 – 87% и снижение EtCO2 до 27 – 29 мм.рт.ст. Увеличение содержания кислорода во вдыхаемой смеси (FiO2) до 100% и положительного давления в конце выдоха (ПДКВ) до 9 - 10 см вод.ст. позволили увеличить SаO2 до 92 – 93%. Сохранялась умеренная гипокапния (EtCO2=29 – 30 мм.рт.ст). Предполагалось, что причиной дыхательных и гемодинамических нарушений являлась воздушная эмболия. Однако источник эмболии выявить не удалось. Возможно, эмболия была криптогенной.
Пациент был переведен в отделение реанимации и интенсивной терапии (ОРИТ) на ИВЛ, с непрерывным введением дофамина.В ОРИТ была продолжена седация. Структура витальных нарушений была прежней, но в течение нескольких часов их выраженность наросла. Кожные покровы приобрели серый оттенок. Симптом белого пятна значительно превышал 5 секунд. Усугубилась артериальная гипотензия. На фоне инфузии дофамина в дозе 9 – 11 мкг/кг/мин АД составляло 60/25 – 70/30 мм.рт.ст., ЧСС – 120 – 140 в мин. Была начата инфузия адреналина в дозе 0,07 – 01 мкг/кг/мин. ЭХО-кардиография выявила лишь незначительное снижение сердечного индекса – 2,2 – 2,4 л/мин/м2, и не привела к принципиальной коррекции интенсивной терапии.Сохранялись гипокапния (РаСО2=26 – 28 мм.рт.ст.) и гипоксемия (РаО2=52 мм.рт.ст.), не смотря на ИВЛ с ПДКВ 10 – 12 см Н2О и FiO2 100%. При рентгенографии грудной клетки были выявлены двусторонние диффузные изменения (Рисунок 3). Соотношение РаО2 к FiO2 менее 200 и данные рентгенографии позволяли поставить диагноз острого повреждения легких. Была начата ИВЛ в синхронизированном режиме с управлением по давлению респиратором Puritan Bennet.В течение 1 суток после операции удавалось стабилизировать АД в пределах возрастных норм, и поддерживать РаО2- 60 -77 мм.рт.ст. на фоне агрессивной ИВЛ. Однако развивались клинические проявления полиорганной недостаточности - развился парез кишечника и олигоурия с повышением уровня креатинина до 155 моль/л. Для адекватной коррекции артериальной гипотензии и проведения ориентированной инфузионной терапии на вторые сутки после операции в легочную артерию был установлен катетера Свана-Ганса диаметром 5 Fr (Arrow, USA). При проведении мониторинга параметров центральной гемодинамики было выявлено значительное снижение индекса общего периферического сосудистого сопротивления (ИОПСС) и признаки гиповолемии. Кроме этого, доставка кислорода была снижена, а уровень лактата артериальной крови – повышен (таблица). Под контролем динамики давления заклинивания легочной артерии (ДЗЛА) и центрального венозного давления (ЦВД) был увеличен объем инфузии 6% раствора гидроксиэтилкрахмала 130/0,4 (ВОЛЮВЕН, Fresenius-Kabi), 20% раствор альбумина (Baxter), сбалансированного кристаллоидного раствора – СТЕРОФУНДИН (B/Braun). В течение суток объем введенных растворов составил (5700 мл при диурезе 700 мл). Была корригирована терапия симпатомиметическими препаратами. Дофамин применялся в инотропной дозе (4 – 5 мкг/кг/час) под контролем динамики значений ударного индекса (УИ). Адреналин был заменен фенилэфрином (мезатоном) в высокой дозе: 5,5 – 6 мкг/кг/мин, которая была подобрана под контролем динамики ИОПСС.Через 3 - 6 часов после коррекции терапии удалось добиться устойчивой стабилизации артериального давления на уровне 120/60 – 130/65 мм.рт.ст., ЧСС составляла 87 – 100 в минуту, ЦВД – 9 – 13 мм.рт.ст., ДЗЛА – 8 – 11 мм.рт.ст.На фоне стабилизации параметров системной гемодинамики отмечалось появление адекватного темпа диуреза с последующим снижением уровня мочевины и креатинина. Стало возможным снизить FiO2 до 45%, ПДКВ до 8 см.вод.ст. При этом удавалось поддерживать параметры газового состава крови в пределах нормы: раО2- 98 - 110 мм.рт.ст., раСО2- 38 – 42 мм.рт.ст. Уменьшение агрессивности параметров вентиляции позволило прекратить введение седативных препаратов. Восстановилась перистальтика кишечника, что позволило начать энтеральное питание.В течение 3 - 5 суток после операции у пациента восстановилось сознание. В этот период удалось постепенно снизить, а затем и прекратить введение фенилэфрина. Гемодинамические показатели оставались стабильными: 110/60 – 100/60 мм.рт.ст., ЧСС – 90- 100 в минуту, ЦВД 10 – 11 мм.рт.ст., ДЗЛА – 12 – 14 мм.рт.ст. на фоне базового комплекса ИТ (объем вводимой жидкости соответствовал базовым потребностям). Катетер Свана-Ганса был удален на третьи сутки после операции. В динамике удалось уменьшить агрессивность ИВЛ. Проводилась SIMV+PS с регуляцией вдоха по объему. FiO2 было снижено до 30%, ПДКВ – до 3 см.вод.ст. По данным рентгенографии органов грудной клетки отмечался регресс диффузных инфильтративных теней, легочные поля стали прозрачными (Рисунок 4).Нормализовалась функция ЖКТ, пациент усваивал необходимый объем энтерального питания. Нарушений электролитного состава плазмы не выявлялось.На 8 сутки после операции пациент был экстубирован. С пациентом был возможен расширенный контакт. Фонация, глотание не были нарушены. Получены движения во всех конечностях. Обращало на себя внимание то, что выраженность тетрасиндрома уменьшилась по сравнению с дооперационным периодом. Дыхание самостоятельное адекватное, гемодинамические показатели стабильны и соответствуют возрастным нормам. Нарушений гомеостаза нет.На 9 сутки пациент переведен в отделение детской нейрохирургии и еще через 14 суток выписан из стационара с клиническим улучшением по сравнению с предоперационным уровнем.
Обсуждение
Приведенное наблюдение описывает пациента детского возраста, у которого после удаления опухоли спинного мозга развилась устойчивой артериальная гипотензия и острое повреждение легких. Это привело к нарушению кровоснабжения и оксигенации органов и тканей. Кожные покровы были серыми, симптом белого пятна превышал 5 секунд, развилась олигоурия. Кроме этого была снижена доставка кислорода и значительно увеличен уровень лактата в артериальной крови. Структура гемодинамического профиля заключалась в снижении сосудистого тонуса (ИОПСС) и гиповолемии (снижение ЦВД и ДЗЛА). Поскольку, это состояние развилось в момент удаления опухоли С1 – С3, то можно предположить, что это был спинальный шок. Причиной развития спинального шока, наиболее вероятно, явилась непрямая манипуляционная травма центров симпатической регуляции сосудистого тонуса в процессе диссекции опухоли. В пользу «непрямого» повреждения свидетельствует достаточно хороший выход пациента из тяжелого состояния и отсутствие усугубления имевшегося до операции тетрапареза и каудальных стволовых нарушений.Использование неинвазивного мониторинга гемодинамики в приведенном наблюдении было неэффективным, поэтому мы были вынуждены начать инвазивный мониторинг центральной гемодинамики. Мониторинг центральной гемодинамики в детской практике – редкое явление, а инвазивный мониторинг - исключение из правила [16,17]. Однако приведенное наблюдение отчетливо свидетельствует о том, что и в детской практике есть ситуации, когда применение инвазивного мониторинга центральной гемодинамики является непременным условием адекватности проводимой терапии. Так, применение инвазивного мониторинга центральной гемодинамики у пациента с клиникой спинального шока позволило выявить гемодинамический профиль и провести адекватную коррекцию выявленных нарушений, избежав перегрузки объемом малого круга кровообращения и других возможных осложнений. Стабилизация параметров гемодинамики в раннем послеоперационном периоде привела к нормализации газового состава крови и снижению уровня лактата в два раза. Это, в конечном счете, позволило избежать неблагоприятного исхода и добиться регресса неврологической симптоматики по сравнению с дооперационным уровнем.
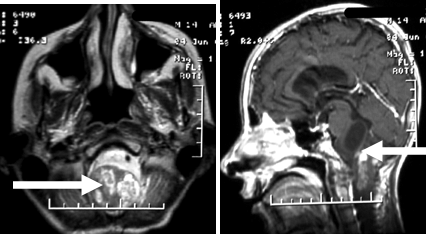
Примечание: стрелками указана опухоль.
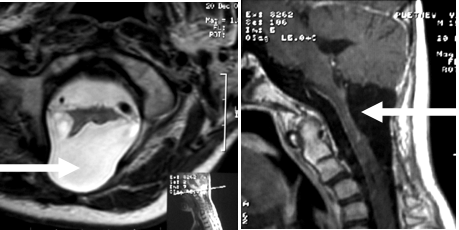
Примечание: стрелками указана полость, образовавшаяся после удаления опухоли.
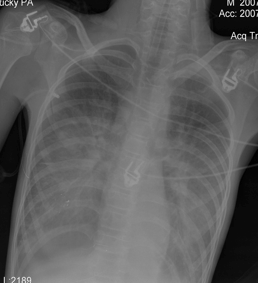
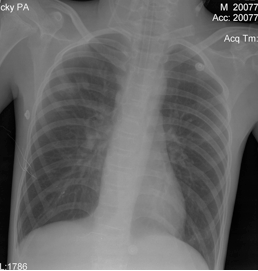
Таблица. Параметры центральной гемодинамики, доставки кислорода, уровня лактата, дозы симпатомиметических препаратов.
| СИ | УИ | ЧСС | ИОПСС | ЦВД | ДЗЛА | АД | Д | А | М | иДост О2 | Лактат | |
| 0 ч. | 4.18 | 29 | 144 | 899 | 4 | 3 | 57/46 (51) | 6.7 | 0.1 | - | 469 | 6.1 |
| 1,5 ч. | 10.55 | 90.1 | 117 | 432 | 9 | 8 | 94/53 (66) | 9.8 | - | 7 | 1438 | 3.4 |
| 5 ч. | 11.82 | 93.1 | 127 | 419 | 13 | 11 | 106/59 (75) | 9.8 | - | 9.4 | 1670 | 2.9 |
| 11 ч. | 9.36 | 74.9 | 125 | 564 | 15 | 12 | 115/64 (81) | - | - | 14 | 1301 | 3.5 |
| 23ч. | 6.39 | 58.1 | 110 | 826 | 11 | 9 | 113/62 (77) | - | - | 14 | 887 | 3.6 |
Крайний левый столбик – указаны часы с момента начала инвазивного мониторинга гемодинамики. СИ – сердечный индекс (норма: 2,5 – 4,0 л/мин/м2). УИ – ударный индекс (норма: 41 – 51 мл/м2 мл/м2). ЧСС – частота сердечных сокращений (норма: 60 – 90 ударов в минуту). ИОПСС – индекс общего периферического сопротивления (норма: 1970 – 2390 динс/(см5м2)). ЦВД – центральное венозное давление (норма: 8 - 10 мм.рт.ст.). ДЗЛА – давление заклинивания легочной артерии (норма: 10 – 15 мм.рт.ст.). АД – артериальное давление (норма АДср: 70 – 110 мм.рт.ст.). Д – дофамин (мкг/кг/мин). А – адреналин (мкг/кг/мин). М – мезатон, фенилэфрин, (мкг/кг/мин). иДост О2 – индекс доставки кислорода (норма: 550 - 650 мл/мин/м2). Лактат (норма: 0,7 – 2,5 ммоль/л)
Литература
- Bilello JF, Davis JW, Cunningham MA, et al. Cervical spinal cord injury and the need for cardiovascular intervention. Arch Surg 2003; 138(10):1127-1129.
- Guidelines for management of acute cervical spinal injury: Blood pressure management after acute spinal cord injury. Neurosurgery, supplement 2002; 50:S58-S62.
- Guidelines for management of acute cervical spinal injury: Management of acute spinal cord injuries in an intensive care unit or other monitored setting. Neurosurgery, supplement 2002; 50:S51-S57.
- Guly HR, Bouamra O, Lecky FE. The incidence of neurogenic shock in patients with isolated spinal cord injury in the emergency department. Resuscitation 2008; 76(1):57-62.
- Ho CC, Kuo CP, Huang ST, et al. Postoperative pulmonary edema after lower thoracic spinal tumor surgery – a case report. Acta Anaesthesiol Taiwan 2007; 45(2):127-130.
- Leal Filho MB, Morandin RC, de Almeida AR, et al. Hemodynamic parameters and neurogenic pulmonary edema following spinal cord injury: an experimental model. Arq Neuropsiquiatr 2005; 63(4):990-996.
- Ledsome JR, Sharp JM: Pulmonary function in acute cervical cord injury. Am Rev Respir Dis 1981; 124:41–44.
- Lehmann KG, Lane JG, Piepmeier JM, Batsford WP: Cardiovascular abnormalities accompanying acute spinal cord injury in humans: Incidence, time course and severity. 1987; J Am Coll Cardiol 10:46–52.
- Lu K, Lee TC, Liang CL, Chen HJ: Delayed apnea in patients with mid- to lower cervical spinal cord injury. Spine 2000; 25:1332–1338.
- Mansel JK, Norman JR: Respiratory complications and management of spinal cord injuries. Chest 1990; 97:1446–1452.
- McMichan JC, Michel L, Westbrook PR: Pulmonary dysfunction following traumatic quadriplegia: Recognition, prevention, and treatment. JAMA 1980; 243:528–531.
- Piepmeier JM, Lehmann KB, Lane JG: Cardiovascular instability following acute cervical spinal cord trauma. Cent Nerv Syst Trauma 1985; 2:153–160.
- Reines HD, Harris RC: Pulmonary complications of acute spinal cord injuries. Neurosurgery 1987; 21:193–196.
- Stevens RD, Bhardwaj A, Kirsch J, et al. Critical care and postoperative management in traumatic spinal cord injury. Review article. Journal of Neurosurgical Anesthesiology 2003; 15(3):215-229.
- Tator CH: Experimental and clinical studies of the pathophysiology and management of acute spinal cord injury. J Spinal Cord Med 1996; 19:206–214.
- Tibby SM, Hatherill M, Marsh MJ, et al: Clinicians’ abilities to estimate cardiac index in ventilated children and infants. Arch Dis Child 1997; 77:516–518.
- Tibby SM, Hatherill M, Murdoch IA. Use of transesophageal doppler ultrasonography in ventilated pediatric patients: derivation of cardiac output. Crit Care Med 2000; 28:2045-2050.
- Tsao CM, Yuan HB, Neu SH, et al. Postoperative pulmonary edema after cervical spinal surgery – a case report. Acta Anaesthesiol Sin 1999; 37(3):147-150.






