TRANSCUTANEOUS DILATION TRACHEOSTOMY IN CHILDHOODI.A. Savin, A.S. Goryachev, K.M. Gorshkov, M.S. Fokin, K.A. Popugayev, A.N. ShcepetkovThe paper presents the experience of transcutaneaus dilatation tracheastomy (TDT) in 16 children. Up to date, childhood has been a contraindication for TDT. The experience gained at the Department of Resuscitation, Institute of Neurosurgery, in performing TDT in more than 300 adult patients has permitted this procedure to be aim used in childhood. Based on the analysis of the outcome of 16 TDTs, the authors have posed indications for TDT, its performance modification, approaches to preventing periaperative complications, by taking into account the anatomic and physiological characteristics of childhood.
Выполнение трахеостомии связано с высоким риском развития различных осложнений (30—40% наблюдений) — от незначительных косметических, до тяжелых, угрожающих жизни больного [6]. Эти осложнения вне зависимости от метода выполнения трахеостомии подразделяют на интраоперационные, ранние и поздние послеоперационные. Они включают: кровотечение, гипоксию, гиперкапнию, создание ложного хода, перфорацию задней стенки трахеи, пневмоторакс, аспирацию, инфицирование стомы и другие, приводящие в отдельных случаях к летальному исходу. Наиболее частым поздним осложнением при трахсостомии является стеноз трахеи. Развитие стеноза трахеи определяется степенью хирургической агрессии в зоне операции и развитием воспалительных изменений в области трахеостомы. В детском возрасте из-за анатомо-физиологических особенностей частота развития стенозов трахеи выше, чем у взрослых [1].
У больных старше 18 лет в последнее время предпочтение отдается методике транскутанной дилатационной трахеостомии (ТДТ) из-за быстроты выполнения, минимальной инвазивности, лучшего косметического результата [3, 7, 9]. Использование ТДТ привело к снижению частоты осложнений до 5—13%, в том числе стенозов трахеи и инфицирования стомы.
Данные о целесообразности использования ТДТ в педиатрии в литературе практически отсутствуют. Более того, детский возраст до настоящего момента являлся противопоказанием для проведения транскутанной трахеостомии из-за анатомо-физиологических особенностей (мягкие хрящи и малый размер трахеи) и соответственно более высокого риска развития ранних хирургических осложнений (перфорация задней стенки трахеи и пищевода, кровотечение, формирование ложного хода, развитие пневмоторакса) [8]. Поэтому в спорных ситуациях в педиатрической практике, особенно у детей младшего возраста, предпочтение до сих пор отдается пролонгированной интубации с использованием безманжеточных трубок. Использование трубок с герметизирующими манжетами связано с высоким риском развития стенозов подсвязочного пространства и тяжело протекающих постинтубационных ларингитов [2]. Однако лечение и реабилитация больных детского возраста с нейрохирургической патологией в ряде ситуаций не возможны без выполнения трахеостомии. Трахеостомия показана при:- поражении стволовых структур мозга, вызывающих бульбарные нарушения и расстройства глотания; - повреждении лицевого скелета опухолью или в результате травмы; - прогнозируемом длительном коматозном состоянии: массивной ликворее, сочетающейся с необходимостью в пролонгированной ИВЛ.
Выполнение ТДТ с использованием фиброскопического (ФБС) контроля позволило значительно снизить количество интраоперационных осложнений, сделав методику более безопасной [5]. В частности, при ФБС-контроле возможно точное определение места пункции за счет эффекта трансиллюминации и предотвращение перфорации задней стенки трахеи.Накопленный в институте опыт более 300 наблюдений ТДТ во взрослом возрасте (из них 100 с ФБС-контролем) и наличие бронхоскопа с внешним диаметром 4 мм позволили в течение последних 2 лет выполнить 16 ТДТ больным в возрасте младше 12 лет. В этой работе рассмотрены преимущества и осложняющие факторы при ТДТ с ФБС-контролем у детей с нейрохирургической патологией.Материал и методы.За 2002—2003 гг. было выполнено 16 ТДТ больным детского возраста.
У 10 больных с опухолями заднечерепной ямки (ЗЧЯ) показаниями для трахеостомии были грубые бульбарные нарушения и расстройства глотания. В 4 наблюдениях нарушения глотания сочетались с тетрапарезом, нарушением механизмов центральной регуляции дыхания с развитием патологических типов дыханияУ больных с тяжелой черепно-мозговой травмой (ТЧМТ) показаниями для трахеостомии являлись; в 2 наблюдениях коматозное состояние (7—8 баллов по шкале комы Глазго) в сочетании с повреждением костей лицевого скелета и массивной ликвореей; в 2 наблюдениях глубокое коматозное состояние (5—6 баллов по шкале комы Глазго) с прогнозируемой длительной ИВЛ.
У 2 больных с супратенториальными новообразованиями показаниями для трахеостомии были глубокое коматозное состояние (кома II - III), псевдобульбарные нарушения и необходимость в длительной ИВЛ. В одном наблюдении в результате разрыва артериовенозной мальформации (АВМ) правой височной доли, гемотампонады желудочковой системы мозга, во втором — в результате кровоизлияния в опухоль с развитием отека головного мозга и дислокацией стволовых структур.Трахеостомия была выполнена у больных с ТЧМТ на 1 - 2-е сутки после поступления и стационар; с опухолями ЗЧЯ на 3—7-е сутки после удаления опухолей; с супратенториаальными новообразованиями трахеостомия была выполнена на 3-м н 7-е сутки после развития коматозного состояния.
Продолжительность ИВЛ через трахеостомичеекую трубку в приведенных наблюдениях была различной.У больных с опухолями ЗЧЯ, сочетанием бульбарных нарушений и тетрасиндрома (4 наблюдения) продолжительность ИВЛ составляла от 14 до 45 сут. У 6 больных с расстройствами глотания, но без нарушения функции дыхательной мускулатуры продолжительность ИВЛ составляла от 3 до 14 сут.У больных с ТЧМТ в 2 наблюдениях с нарушением сознания до 7 - 8 баллов по шкале комы Глазго, ИВЛ через трахеостому продолжалась 7 и 8 сут. У 2 больных с угнетением сознания до 5 - 6 баллов по шкале комы Глазго, ИВЛ продолжалась14 и 25 сут.
У больной с кровоизлиянием в результате разрыва АВМ ИВЛ продолжалась в течение 30 сут. В наблюдении с развитием дислокации в результате кровоизлияния в опухоль ИВЛ продолжалась в течение 17 сут.Сроки канюленосительства в приведенных наблюдениях были различными.У больных с опухолями ЗЧЯ в 4 наблюдениях канюленосительство продолжалось от 1 до 6 мес. 5 больных были выписаны из стационара "хроническими" канюлярами, 1 больной умер из-за множественных прободных язв желудочно-кишечного тракта, разлитого перитонита, полиорганной недостаточности, ИВЛ этому больному проводилась в течение всего послеоперационного периода — 30 сут.
У 2 больных с ТЧМТ и краниофациальной травмой, осложненной ликвореей (7—8 баллов по шкале комы Глазго), после отключения от респиратора канюленосительство продолжалось в течение 14 и 20 сут. Деканюляцию осуществляли после выполнения реконструктивных операций по поводу ликвореи. В 2 наблюдениях (5 - 6 баллов по шкале комы Глазго) канюленосительство продолжалось в течение 30 - 45 сут до регресса псевдобульбарных нарушений.Больной с АВМ был выписан из стационара на 70-е сутки после выполнения трахеостомии, "хроническим" канюляром. Больной с опухолью хиазмально-селлярной локализации был выписан из стационара на 40-е сутки "хроническим" канюленосителем. В обоих случаях после восстановления самостоятельного дыхания из-за грубых рисстройств глотания сохранялась необходимость в трахеостомических трубках с герметизи-руюшей манжетой.
Деканюляцию больных проводили по единой схеме. Показаниями для деканюляции являлись восстановление сознания, устойчивое бодрствование, самостоятельное глотание, кашлевой рефлекс, отсутствие дыхательной недостаточности, гнойно-воспалительных осложнений со стороны органов дыхания. Перед деканюляцией с помощью бронхоскопии исключались верхние и нижние стенозы трахеи. Деканюляцию проводили после выполнения функциональных проб.
Проба 1. Оценивалось качество самостоятельного дыхания через естественные дыхательные пути при удаленной трахеосотмической трубке и закрытой стоме (трахеостому заклеивали пластырем). При затруднении самостоятельного дыхания через естественные пути из-за снижения тонуса и детренированности мышц гортаноглотки больной проходил этап дыхательной реабилитации с использованием фонационных клапанов и канюль Biesalsky.
Проба 2. Перед переходом на использование безманжеточной трубки у больных с расстройствами глотания производилась ФБС, во время которой больной глотал водный раствор метиленового синего. У трахеостомированного больного ФБС осуществляли через стому. При грубых расстройствах глотания визуализировали поступление метиленового синего в трахею. Особое значение этот тест имеет у больных с грубым снижением чувствительности слизистой оболочки гортани, трахеи и отсутствием кашлевого рефлекса в связи с высокой вероятностью "немой" аспирации.Ни в одном из 16 наблюдений поздних осложнений ТДТ (гнойно-воспалительных, верхних/нижних стенозов, трахеопищеводных свищей) выявлено не было. Закрытие стомы после деканюляции происходило в среднем в течение 24 ч, формирование кожного рубца в течение 3 - 7 сут. Во всех наблюдениях косметический дефект был минимальным.Выполнение ТДТ у детей имело ряд особенностей. Все операции были выполнены прикроватно. В операции участвовали 2 реаниматолога, эндоскопист. Бронхоскопию выполняли дискретно. Операции проводились под внутривенной анестезией. Для вводной анестезии использовали пропофол в дозе 5—30 мг/кг. Для обезболивания применяли фентанил в дозе 2,5—5 мкт/кг, атропин и ардуан — в возрастной дозе. После вводного наркоза всем больным (исключая пациентов с ТЧМТ и повышенным внутричерепным давлением) придавали положение с разгибанием шеи. Больным с ТЧМТ пункционную трахеостомию выполняли без укладывания валика под плечи и выведения шеи кпереди.
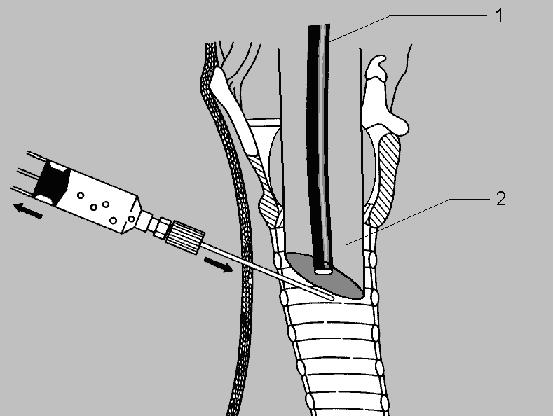
Для ФБС использовали бронхоскоп STORZ 11002BD1 с наружным диаметром 4 мм и возможностью аспирации и введения лекарств через инструментальный канал. Интубационную трубку выдвигали вверх на 0,3—0,7 см выше места предполагаемого вкола. Место пункнии определяли пальпаторно с использованием трансиллюминации (световое пятно бронхоскопа, видимое через ткани (рис. 1). В связи с появлением препятствия потоку воздуха в момент проведения бронхоскопии, корректировались параметры ИВЛ: увеличивалась частота дыхания в 1,5—2 раза, уменьшался дыхательный объем в 2—3 раза, вентиляция осуществлялась 100% кислородом.Продолжительность бронхоскопии составляла от 1 до 3 мин. После выдвижения трубки, без применения местной анестезии (из-за опасности нарушить внешние анатомические ориентиры) производили пробную пункцию трахеи иглой диаметром 0,7 мм, соединенную со шприцем с физиологическим раствором. Пункцию трахеи выполняли поя контролем фиброскопии. Пункционную иглу продвигали медленно во избежание ранения задней стенки трахеи. Для того чтобы уменьшить проминирование передней стенки трахеи, применяли умеренное сжатие трахеи со стороны боковых стенок. Фиброскопический контроль позволял установить интубационную трубку так, чтобы место пункции находилось непосредственно под дистальным концом интубационной трубки. Таким образом, интубационная трубка выполняла роль дополнительного внутреннего каркаса трахеи (рис. 2). В момент пункции в шприце создавали постоянное разряжение. При получении пузырьков воздуха продвижение иглы прекращали. Затем но имеющемуся ориентиру проводили пункцию трахеи иглой диаметром 1 мм, соединенной со шприцем с физиологическим раствором.
При получении пузырьков воздуха на фоне постоянного разряжения в шприце, с помощью фиброскопии (рис. 2) визуализировали конец иглы в трахее, если было необходимо, интубационную трубку подтягивали еше на 1 - З мм и меняли наклон иглы. Затем в трахею через иглу вводили металлический проводник диаметром 0,6 мм. Правильная позиция проводника в трахее контролировалась с помощью фиброскопии. Пункционную иглу снимали с проводника. Затем осуществляли горизонтальный разрез кожи под соответствующий размер трахеостомическои трубки. Далее раздвигали мягкие ткани шеи и расширяли отверстие в трахее тупым способом с помощью дилятаторов, вводимых в трахею по установленному металлическому проводнику (по методике Ciaglia). После формировании стомы устанавливали трахеостомическую трубку по проводнику. После этого осуществляли контрольную бронхоскопию через трахеостомическую трубку для уточнения ее позиции. После оценки адекватности вентиляции через трахеостомическую трубку ее фиксировали, а интубационную трубку удаляли. Операцию завершали санационной бронхоскопией.Длительность операции от момента пункции трахеи до начала ИВЛ через трахсостомическую канюлю составляла от 1,5 до 6 мин. В одном наблюдении в момент пункции трахеи иглой 1 мм было получено артериальное кровотечение (около 50 мл), что потребовало перехода к хирургической трахеостомии. Во всех остальных наблюдениях не было отмечено каких-либо интраоперационных и ранних послеоперационных осложнений.
Результаты исследований и их обсуждение.Во всех наблюдениях показания к проведенной ранней трахеостомии были очевидными, В группе больных, оперированных по поводу опухолей ЗЧЯ, формирование в послеоперационном периоде грубых и длительно регрессирующих расстройств глотания, даже при активном бодрствовании больного, отсутствии легочной патологии и сохранной функции дыхания, не оставляет альтернатив трахеостомни. Проведение реабилитации, в том числе дыхательной, отучение от респиратора не возможны без использования трубок с герметизирующей манжетой из-за постоянной угрозы развития аспирации.
У больных с ТЧМТ, повреждениями лицевого скелета, ликвореей трахеостомия значительно снижает риск развития менингоэнцефалита, позволяя адекватно санировать носоротоглотку. Кроме того, проведение реконструктивных операций в большинстве случаев затруднительно при назо/оротрахеальной интубации. Показания для ранней трахеостомии у больных с распространенными краниофациальными опухолями в целом такие же.В настоящее время доказано, что проведение длительной ИВЛ у больных, находящихся в коматозном состоянии, через интубационную трубку значительно повышает частоту инфекционных осложнений (отиты, синуситы), принципиально затрудняет санацию носоротоглотки и трахеи, особенно у детей при использовании интубационных трубок малого диаметра. Поэтому у больных с прогнозируемым длительным коматозным состоянием оправдана ранняя трахеостомия. При восстановлении сознания и самостоятельного дыхания отключение от респиратора трахеостомированного больного происходит значительно легче, с меньшим риском для больного. Наличие трахеостомической трубки позволяет немедленно возобновить ИВЛ при начальных признаках дыхательной недостаточности. Помимо этого самостоятельное дыхание через трахеостомическую трубку значительно выгоднее для больного за счет уменьшения цены дыхания (предупреждается одышка, снижается сопротивление верхних дыхательных путей).Наиболее серьезными интраоперационными осложнениями чрескожной трахеостомии являются гипоксия, гиповентиляция, гиперкапния, кровотечение, формирование ложного хода, перфорация задней стенки трахеи, пневмоторакс [10].
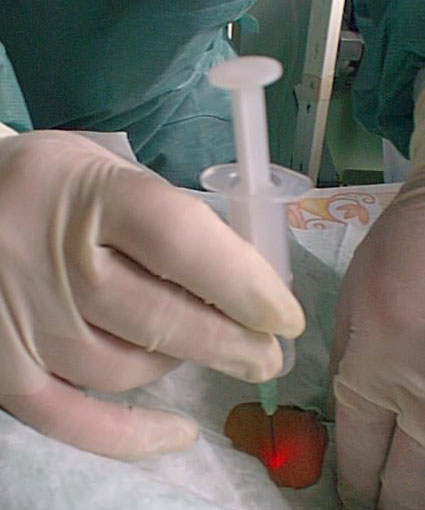
(Рис. 3) Для предупреждения развития гипоксии, гиповентилянии, гиперкарбии предварительно корректировались параметры вентиляции, уменьшался дыхательный объем, увеличивалась частота дыханий с учетом повышения сопротивления потоку при введении бронхоскопа в интубационную трубку. Время бронхоскопии ограничивали в зависимости от данных SaО2 и EtCO2- Соотношение диаметра бронхоскопа (4 мм) и внутреннего диаметра итубационной трубки (6 - 5,5 мм) оставляло свободным не менее 25—30% просвета трубки, что позволяло проводить фиброскоиию без угрозы развития гипоксии и гиперкарбии в течение 2 - 3 мин. В представленном клиническом материале (16 наблюдений) отмечено одно кровотечение при выполнении пункции трахеи, причиной которого было атипичное расположение сосудов, кровоснабжающих щитовидную железу, что потребовало выполнения открытой хирургической трахеостомии. Как способ профилактики подобного осложнения возможно применение ультрасонографии сосудистых образований шеи перед операцией [4].Применение фиброскопического контроля позволило нам предотвратить развитие таких осложнений, как формирование ложного хода и перфорации задней стенки трахеи. Пальпация трахеи в сочетании с трансиллюминацией сделала возможным точное определение места пункции трахеи во всех наблюдениях. В ходе пробной пункции тонкой иглой под контролем фиброскопии оценивали степень проминирования трахеи и необходимую глубину введения иглы. В ряде случаев трахея была столь эластична, что в момент пункции за счет сдавления передняя стенка прижималась к задней стенке трахеи. В этой ситуации для предупреждения ранения задней стенки трахеи нижний срез интубационной трубки смещали вниз до уровня 1—2 мм выше места пункции.
Таким образом, интубационная трубка играла роль внутреннего каркаса трахеи. Фиброскопия позволяла контролировать необходимое усилие пальцев ассистента, осуществляющего боковое сжатие трахеи. Этими маневрами удавалось сохранять просвет трахеи в момент пункции и визуализировать положение иглы в трахее. Во всех случаях иглу продвигали очень медленно, чтобы обеспечить возможность реакции хирурга на рекомендации эндоскописта. По нашему мнению использование видеомонитора с выведением изображения на экран могло бы упростить выполнение этого этапа вмешательства. Стандартные наборы для выполнения ТДТ у детей были дополнены более тонким металлическим проводником (0,6 мм), проводимым через металлическую иглу (1 мм) с коротким срезом, пластиковый интрадюсер для металлического проводника не использовали.
Для предупреждения развития ранений и надрывов слизистой оболочки трахеи дилятаторы и трахеостомическую трубку обрабатывали специальным лубрикантом, глубину введения дилататоров определяли индивидуально в соответствии с диаметром трахеостомической канюли.Ни в одном из наблюдений не было отмечено инфицирования трахеостомы и развития стеноза трахеи. Зона гиперемии вокруг стомы не превышала 1 мм. Сразу после установки трахеостомической трубки, зону трахеостомы обрабатывали местными антисептиками и накладывали марлевые салфетки с мазью “Betadin”. Первую смену трахеостомической трубки осуществляли на 5 сутки по проводнику, затем по мере необходимости, но не реже двух раз в неделю.Особое внимание уделяли обработке и санации полости рта, с использованием местных антисептиков (Hexoral). Эти меры позволили предотвратить развитие воспалительных осложнений в гортани и отделах трахеи выше стомы.
После перевода трахеостомированных больных на самостоятельное дыхание увлажнение трахеи обеспечивали при помощи искусственных «носов» и ультразвуковых ингаляторов. Санацию трахеобронхиального дерева при необходимости дополняли бронхоскопией. Особенностями ТДТ в детском возрасте по нашему мнению являются: необходимость эндоскопического контроля, большой опыт оперирующих врачей выполнения ТДТ у взрослых, относительная техническая сложность на этапе пункции трахеи и проведения металлического проводника.Основным ограничением при выполнении ТДТ у детей является сохранение достаточного просвета трубки в ходе фиброскопии для проведения эффективной ИВЛ. При наших возможностях минимальный диаметр трубки был 5,5 мм. Это соответствует возрасту 4 – 5 лет.Учитывая вышесказанное, мы можем рекомендовать ТДТ у детей только при наличии значительного опыта выполнения этой операции и соответствующих технических возможностях. Для повышения безопасности ТДТ необходимо в каждом случае обеспечивать возможность экстренного перехода к хирургической трахеостомии.
Таблица 1. Распределение наблюдений по патологии головного мозга.
| Патология головного мозга | Опухоли задней черепной ямки | ТЧМТ | Гигантская глиома хиазмы | Артериовенозная мальформация височной области |
| Количество наблюдений | 10 | 4 | 1 | 1 |
| Возраст больных | 5 – 8 лет | 9 – 12 лет |
| Количество наблюдений | 10 | 6 |
Резюме
В статье приводится опыт выполнения транскутанной дилятационной трахеостомии (ТДТ) 16 пациентам детского возраста. До настоящего времени детский возраст являлся противопоказанием для проведения ТДТ. Накопленный в отделении реанимации Института нейрохирургии опыт проведения ТДТ более чем у 300 пациентов взрослого возраста, позволил использовать эту методику и в детском возрасте.На основании проведенного анализа результатов выполнения 16 ТДТ сформулированы показания, модификация методики выполнения, подходы к профилактике периоперационных осложнений с учетом анатомо-физиологических особенностей детского возраста.Москва, НИИ нейрохирургии им акад. Н.Н. Бурденко, РАМН (дир. акад.., проф. Коновалов А.Н.), отделение интенсивной терапии и реанимации.
Литература
- Carr M., Poje P. Complication in Pediatric tracheostomies.// Laryngoscope 2001; 111. 1925 – 1928.
- Carron J., Craig S., Strope L., et al. Pediatric tracheostomies: changing in indication and outcomes. //Laryngoscope 2000. V 110. p. 1099 – 1104.
- Russell C., Matta B. Tracheostomy: A Multiprofessional Handbook. 2004, 392 pp. GMM.
- Holdgard H.O., Pedersen J., Jensen R.H., et al. Percutaneous dilatation traсheostomy versus conventional surgical traheostomy. //Acta Anaesthesiol. Scand. 1998. V. 42. p. 545 – 550.
- Kollig E., Heidenreich U., Roetman B., et al. Ultrasound and bronhoscopic controlled percutaneous tracheostomy on trauma ICU .// Injury . 2000. V. 31. p. 663 –668.
- Kost K.M. Optimum technique of percutaneous tracheostomy. //Int. J. of Intensive Care. 2001.
- Rogers S., Puyana J.S. Bedside percutaneous traheostomy in the critically ill patient. //Int. Anesth. Clin. 2000. V. 38. p. 95 – 110.
- Scott C.J., Darowski M., Crabbe D. Complication of percutaneous dilatation traсheostomy in children.// Anesthesia . 1998. V. 53. p. 477 – 485.
- Succo G., Crossetti E., Pecorari G., et al. Complication of traсheostomy in critically ill patients: comparison of dilatation and surgical techniques.// Acta Otorhinolaryngol. Ital. 2002. V. 22. Suppl. 71. p. 1 – 11.
- Thomas E.O., Manara A.R. A review of percutaneous tracheostomy. //Br. J. of Intensive Care. 1998. p. 1 – 4.