АД - артериальное давление
ВВЭ - венозная воздушная эмболия
ВСА - внутренняя сонная артерия
ИВЛ - искусственная вентиляция легких
КМА - калия магния аспарагинат
КТ - компьютерная томография
КФК - креатининфосфокиназа
ЛДГ -лактатдегидрогеназа
ЛЖ - левый желудочек
ЛСК - линейная скорость кровотока
НСА - наружная сонная артерия
ОРДС - острый респираторный дистресс-синдром
ОСА - общая сонная артерия
ПА - позвоночная артерия
ПВЭ - парадоксальная воздушная эмболия
ПДКВ - положительное давление конца выдоха
СИ - сердечный индекс
УЗИ - ультразвуковое исследование
ФВ - фракция выброса
ЧД - частота дыхания
ЧСС - частота сердечных сокращений
ЭКГ - электрокардиография
ЭхоКГ - эхокардиография
ЭЭГ - электроэнцефалография
EtCO2 - показатель углекислого газа в конце выдоха
FiO2 - фракция кислорода в дыхательной смеси
SpO2 - пульсоксиметрия
Парадоксальная воздушная эмболия - редкое, но потенциально тяжелое, жизнеугрожающее осложнение, при котором воздушные эмболы из правых отделов сердца и легочной артерии попадают в артерии большого круга кровообращения, вызывая их окклюзию. В нейрохирургической практике ПВЭ наиболее часто встречается при операциях в положении сидя либо в положении с возвышенным головным концом - как вторичное осложнение венозной воздушной эмболии [1-4]. Внутрисердечное шунтирование через не полностью заращенное овальное окно - наиболее частая причина ПВЭ, но к парадоксальной эмболии во время анестезии может привести и функционирование внутрилегочных артериовенозных шунтов [5, 6]. Потенциально эти воздушные эмболы могут попасть в любые артериальные сосуды, однако чаще всего отмечается их попадание в сосуды головного мозга (ветви средней мозговой артерии) [1, 2]. Однако в описываемом нами клиническом наблюдении ПВЭ привела к нарушению не только мозгового кровообращения, но и коронарного, с формированием острого инфаркта миокарда.
Клиническое наблюдение. Мужчина, 48 лет, поступил в НИИ нейрохирургии с диагнозом «астроцитома продолговатого мозга и холестеатома левого мостомозжечкового угла» для выполнения открытой биопсии опухоли продолговатого мозга в условиях нейрофизиологического мониторинга. На догоспитальном этапе выполнены: ЭКГ, ЭЭГ, УЗИ вен нижних конечностей, общий и биохимический анализ крови, общий анализ мочи - отклонений от возрастной нормы выявлено не было. По данным анамнеза, какая-либо патология сердца у пациента отсутствовала.
В операционной пациенту выполнен стандартный мониторинг, включавший в себя трехканальную ЭКГ, инвазивное измерение артериального давления, пульсоксиметрию (SpO2). После индукции анестезии (пропофол + фентанил + рокуроний) проведена оротрахеальная интубация трахеи без технических сложностей, начато измерение углекислого газа в конце выдоха (EtCO2). ИВЛ проводилась в режиме принудительной механической вентиляции (CMV), МОД=6,0 л/мин, ЧД=14, фракция вдыхаемого кислорода 35%. Без технических сложностей пунктирована и катетеризирована трехпросветным катетером правая яремная вена, положение катетера в венозном русле подтверждено получением обратного тока крови по трем портам. Голова пациента была фиксирована в скобе Мейфилда. Перед переводом в положение сидя АД составило 130-100/70-60 мм рт.ст., ЧСС 70 уд/мин, SpO2=99%, EtCO2=37 мм рт.ст. После перевода пациента в положение сидя отмечалась непродолжительная артериальная гипотензия (минимальное АД 50/40 мм рт. ст), гемодинамика стабилизирована форсированным в/в введением кристаллоидных и коллоидных растворов (NaCl 0,9% 800 мл, КМА 250 мл, тетраспан 500 мл). АД стабилизировано на уровне 90/40 мм рт.ст.
На этапе трепанации черепа зафиксирован кратковременный эпизод венозной воздушной эмболии из неустановленного источника со снижением EtCO2 с 36 до 20 мм рт.ст. и SpO2 - с 98 до 93%, сопровождавшийся снижением АД до 50/30 мм рт.ст., в связи с чем начата вазопрессорная поддержка норадреналином в дозе 0,03 мкг/кг в минуту. В результате АД стабилизировано на уровне 140-110/70-50 мм рт.ст. На этапе проведения биопсии новообразования ствола мозга произошел повторный эпизод массивной венозной воздушной эмболии со снижением SpO2 до 94%, EtCO2 до 23 мм рт.ст., АД до 20/10 мм рт.ст., потребовавший увеличения вводимой дозы норадреналина до 0,1 мкг/кг в минуту, проведения непрямого массажа сердца в течение 3 мин (аускультативно над правыми отделами сердца выслушивался характерный для воздушной эмболии «шум мельничных колес»), перевода пациента на дыхание 100% кислородом. Данный эпизод сопровождался появлением изменений на ЭКГ-мониторе, свидетельствующих о развитии миокардиальной ишемии. Источник эмболии остался неустановленным, несмотря на мануальную компрессию шейных вен. В связи с подозрением на кардиальную катастрофу интраоперационно была снята 12-канальная ЭКГ. На ЭКГ отмечалось появление признаков острого коронарного синдрома (элевация сегмента ST V1-V5, формирование зубца QS V1-V2) (рис. 1), которых не было на дооперационной электрокардиограмме (рис. 2).
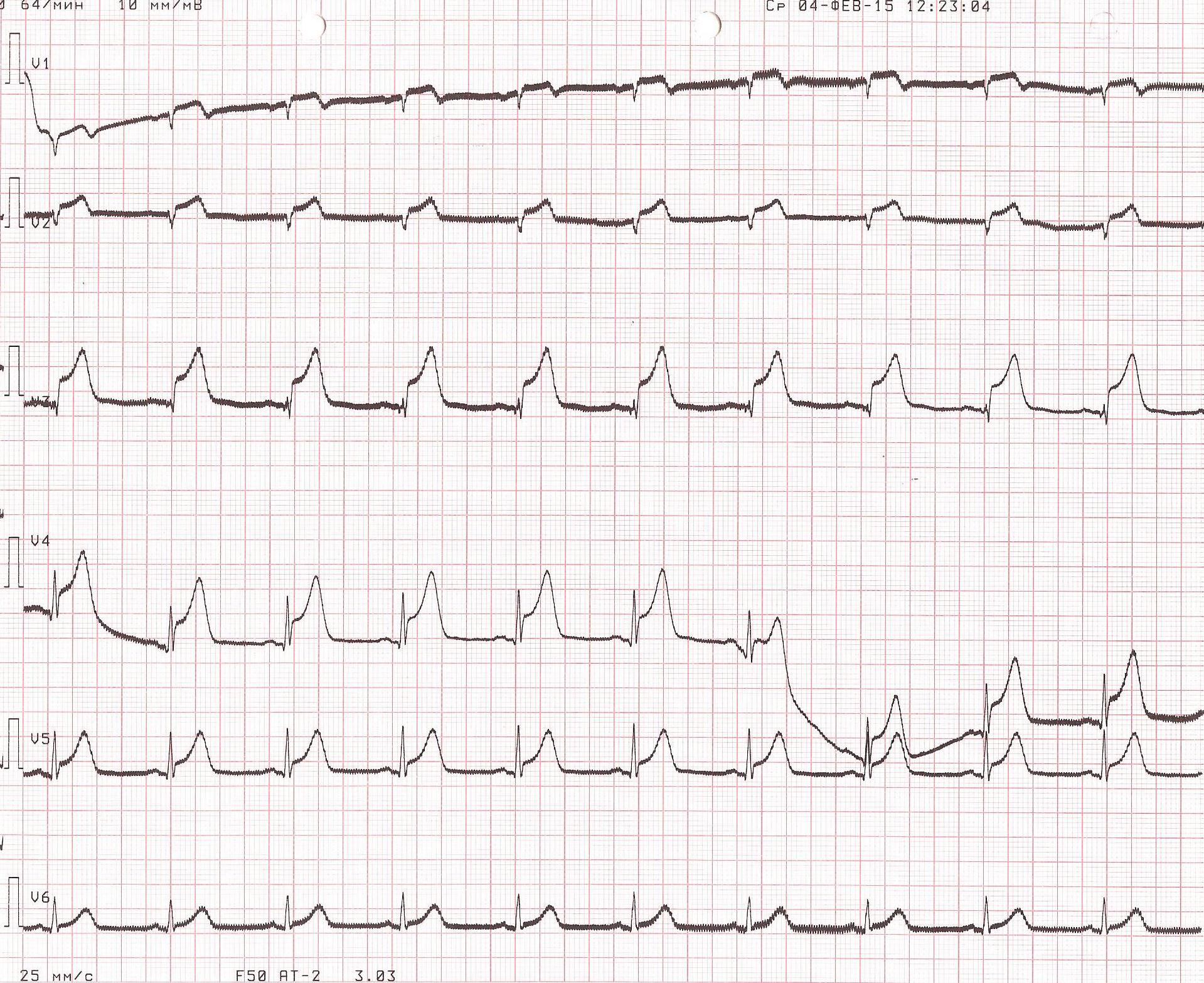
Рис. 1. ЭКГ пациента, выполненная интраоперационно. Ритм синусовый, горизонтальная ЭОС. Элевация сегмента ST V1-V5, формирование зубца QS V1-V2.
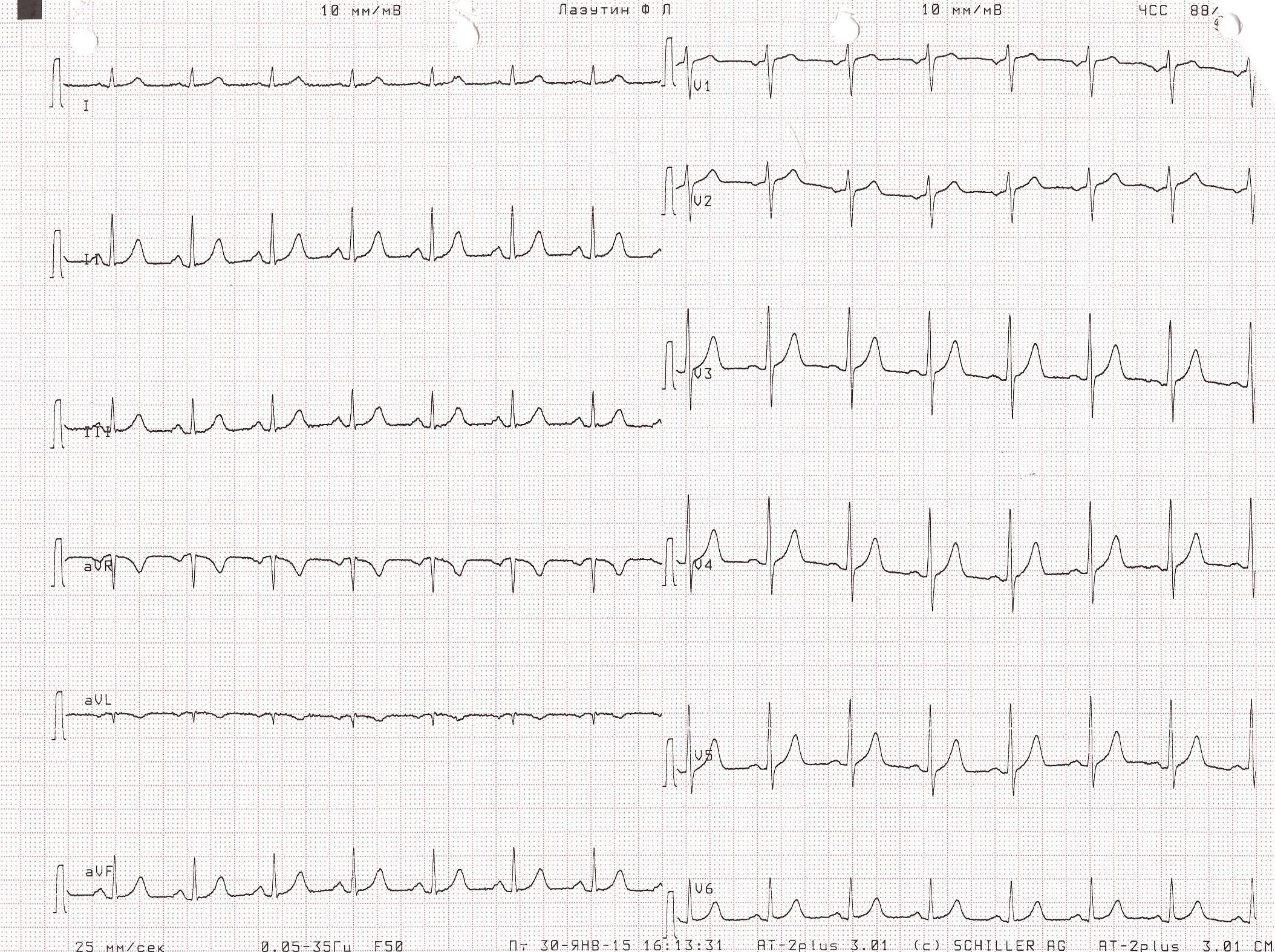
Рис. 2. ЭКГ пациента до операции. Какая-либо патология отсутствует. АД удалось стабилизировать на уровне 120/70 мм рт.ст., ЧСС - 80 уд/мин. Учитывая развитие тяжелого интраоперационного осложнения, операцию решено прекратить, и пациент в состоянии наркозного сна доставлен в отделение реанимации и интенсивной терапии, где была продолжена ИВЛ в режиме синхронизированной перемежающейся принудительной вентиляции (SIMV) - PC, ЧД=12, FiO2=0,4, SpO2=99%. Сохранялась тенденция к гипотонии, требовавшая дополнительной инфузионной терапии коллоидными и кристаллоидными растворами и увеличения дозы норадреналина. На рентгенограмме органов грудной полости (рис. 3) появилось диффузное снижение прозрачности обоих легочных полей по типу «матового стекла».
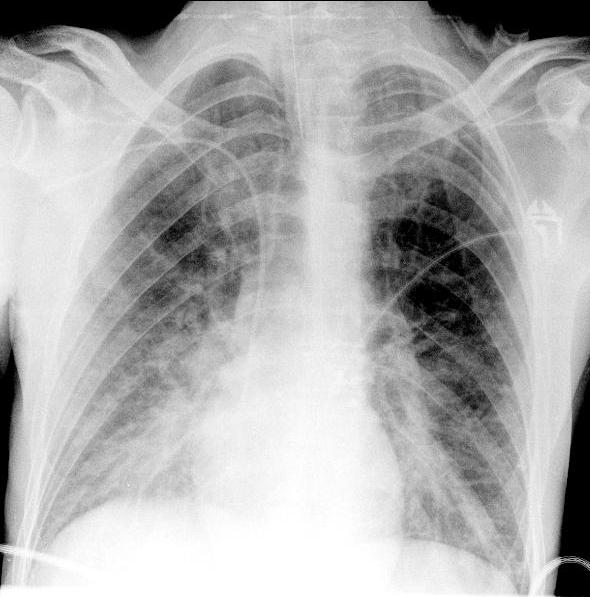
Рис. 3. Рентгенограмма органов грудной полости в прямой проекции. Тень средостения не смещена. Отмечается выраженное диффузное снижение прозрачности легочной ткани по типу «матового стекла». Выполнена ЭхоКГ, по данным которой отмечалась субтотальная гипокинезия левого желудочка со снижением показателей насосной функции сердца: ФВ 41-42%, СИ=1,8 л/мин·м2. По данным биохимического анализа крови, тропонин 1,06 мкг/л (N<0,1 мкг/л); КФК 166 Ед/л (N<200 Ед/л).
В связи с отсутствием признаков пробуждения в течение 2 ч и нарастанием неврологической симптоматики в виде появления анизокории (D>S) выполнена компьютерная томография головного мозга, выявившая массивную пневмоцефалию (рис. 4).
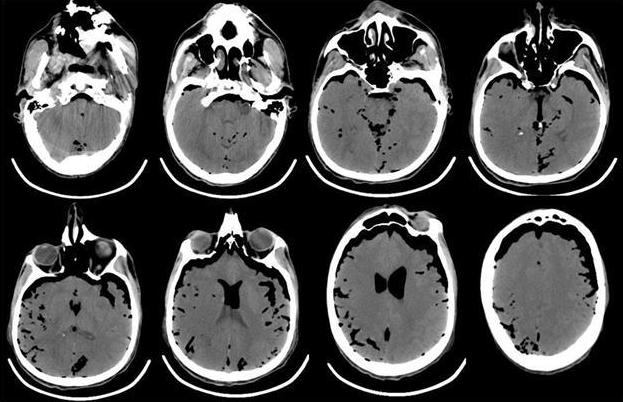
Рис. 4. КТ-головного мозга пациента, выполненная сразу после операции. Отмечается выраженная пневмоцефалия. В течение первых 12 ч после операции в структуре неврологического статуса у больного отмечалось нарастание общемозговой и очаговой неврологической симптоматики. Отсутствовала реакция на обращенную речь, болевое и струйное раздражение лица. При пассивном поднимании век взор неподвижный, двусторонний мидриаз без фотореакции. Роговичные, окулоцефалический и кашлевой рефлексы отсутствуют. Мышечная атония, арефлексия. Гемодинамика с тенденцией к артериальной гипотензии, несмотря на возрастающие дозы норадреналина максимально до 5 мкг/кг в минуту. Выполненная повторная КТ через 12 ч с момента поступления из операционной выявила диффузный отек головного мозга с отсутствием дифференцировки серого и белого вещества, пневмоцефалию (рис. 5).
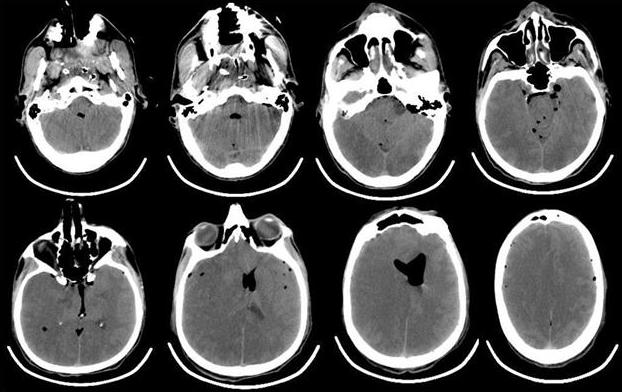
Рис. 5. КТ-головного мозга пациента, выполненная через 12 ч после операции. Отмечается формирование выраженного отека мозгового вещества, с признаками латеральной дислокации. Остаточная пневмоцефалия. Снижение дифференцировки серого и белого вещества. В первые послеоперационные сутки состояние пациента оставалось без положительной динамики, сохранялись диффузная мышечная атония, арефлексия, артериальная гипотония на фоне применения высоких доз норадреналина. По результатам биохимического анализа крови: КФК 845 (N<200 Ед/л), ЛДГ 665 Ед/л (N=100-190 Ед/л), тропонин 18,76 (N<0,1 мкг/л). По данным допплерографии, артерии виллизиева круга не визуализируются. В артериях шеи (ОСА, ВСА, НСА и ПА) при цветном допплеровском картировании прокрашивание спонтанное, ЛСК=20 см/с. Повторно выполнена ЭхоКГ, которая показала: ФВ 31-33%, СИ=2,6 л/мин·м2, увеличение размеров Л.Ж. Значительное снижение локальной сократимости ЛЖ с формированием аневризмы в области верхушки и средних отделов ЛЖ с формирующимися неплотно фиксированными тромботическими массами, практически занимающими всю верхушку, и значительное снижение показателей насосной функции ЛЖ.
В дальнейшем состояние пациента оставалось крайне тяжелым - атоническая кома; гемодинамические параметры поддерживались в пределах нормальных значений только на фоне постоянной инфузии норадреналина в максимальной дозировке. На 12-е сутки нахождения в отделении реанимации и интенсивной терапии констатирована смерть пациента: он скончался на фоне нарастающей сердечно-сосудистой недостаточности. Вскрытие пациента не производилось по настоянию его родственников.
Обсуждение
В приведенном клиническом случае описано достаточно редкое наблюдение развития парадоксальной воздушной эмболии с поражением сосудов головного мозга, коронарных артерий и легких. В литературе нами найдено лишь несколько описаний похожих клинических наблюдений. При этом стоит отметить, что воздушная эмболия коронарных сосудов, описанная во всех литературных источниках, проявлявшаяся изменениями на электрокардиограммах и гемодинамической нестабильностью, регрессировала в течение небольшого промежутка времени (до 30 мин), на фоне инотропной и инфузионной терапии. Также во всех наблюдениях отмечалось преимущественное попадание воздушных эмболов в правую коронарную артерию [7, 8].
Венозная воздушная эмболия является достаточно распространенным осложнением нейрохирургических вмешательств, выполняемых в положении сидя [2, 4, 9-12]. По данным разных авторов [1-3, 5, 11, 13], частота данного осложнения колеблется в диапазоне 1,6-76%, в зависимости от того, какие эпизоды ВВЭ фиксируют авторы (все или только массивные), и использованного метода диагностики ВВЭ, которые обладают различной чувствительностью. Наиболее часто органом-мишенью при воздушной эмболии являются легкие. Тяжесть легочного повреждения варьирует от бессимптомного до ОРДС [1, 2]. При наличии открытого овального окна или внутрилегочного шунта создаются предпосылки для попадания воздуха в большой круг кровообращения [1, 2, 6, 14]. При этом могут возникать ишемические повреждения любых органов, однако наиболее часто поражаются головной мозг, кожные покровы, миокард [1, 2, 5]. Частота встречаемости открытого овального окна в популяции, по данным разных авторов (прежде всего по результатам секционного исследования случайных неотобранных умерших от разных причин), составляет от 5 до 33% [3, 5, 13, 15]. Предоперационное обследование, включающее трансторакальную допплерографию с проведением теста Вальсальвы и применением контраста, не позволяет у 1/3-½ части пациентов выявить данную аномалию [16]. Во-первых, метод трансторакальной допплерографии недостаточно чувствителен для выявления открытого овального окна; во-вторых, в ряде случаев овальное окно начинает функционировать лишь в условиях повышенного внутригрудного давления при проведении ИВЛ. Особенно ситуация усугубляется при развитии ВВЭ, так как возникающее повышенное давление в правом желудочке вследствие массивного попадания воздуха в легочные капилляры приводит к повышению давления в малом круге кровообращения и открытию овального окна. Это клинически достаточно важная информация в аспекте профилактики ПВЭ: 1) с помощью даже трансэзофагеальной ЭхоКГ мы можем, и то не всегда, диагностировать у больного наличие функционирующего овального отверстия; 2) наличие же и функционирование сосудистых анастомозов между системой легочной артерии и бронхиальными артериями диагностировать вообще невозможно, они ответственны за летальные исходы вследствие ПВЭ с верифицированным отсутствием септальных дефектов в сердце [17].
Специфических методов лечения повреждения легких на фоне венозной воздушной эмболии в настоящее время нет. Существует ряд работ, показывающих эффективность гипербарической оксигенотерапии у пациентов, перенесших ВВЭ. Стоит отметить, что данная терапия применялась у ныряльщиков с аквалангом, которые вследствие нарушения техники всплытия переносили кессонную болезнь, когда также отмечается появление пузырьков азота в кровеносном русле [18, 19]. Есть данные об эффективности ИВЛ 100% для вымывания азота и таким образом уменьшения объема пузырьков воздуха [20]. В целом лечение ВВЭ носит симптоматический характер и направлено на коррекцию органной недостаточности. При ВВЭ повреждение легких зачастую носит характер классического ОРДС [19, 21]. В этих случаях, согласно концепции открытых легких, проводится респираторная поддержка, включающая проведение рекрутмент-маневра и использование адекватного уровня ПДКВ. При наличии открытого овального окна или внутрилегочного шунтирования, приведшего к ПВЭ, может развиться полиорганная недостаточность, требующая соответствующего подхода и интенсивной терапии [22]. Повреждение головного мозга при ПВЭ обусловливает необходимость проведения нейропротекции. Одним из наиболее эффективных методов нейропротекции является проведение ретроградной церебральной перфузии и церебральной или системной гипотермии, однако эффективность данной методики у пациентов с парадоксальной воздушной эмболией в настоящий момент мало изучена [12, 23, 24]. Воздушная эмболия коронарных сосудов может приводить к развитию инфаркта миокарда, клинические и лабораторные проявления которого неотличимы от инфаркта миокарда атеротромботического генеза. Однако, учитывая отсутствие коронарного тромбоза, подходы к лечению острого инфаркта миокарда вследствие ПВЭ отличаются от принятых стандартов ведения пациентов с острым коронарным синдромом. Очевидно, что проведение фибринолитической, антиагрегантной и антикоагулянтной терапии у данной категории пациентов будет неэффективно и даже опасно из-за риска интракраниальных геморрагических осложнений при введении антикоагулянтов и фибринолитиков на фоне свежей нейрохирургической раны. Основными терапевтическими опциями являются коррекция центральной гемодинамики, при необходимости использование инотропной поддержки [25]. Также представляется целесообразным назначение β-адреноблокаторов, обеспечивающих, во-первых, удлинение диастолы и таким образом улучшение коронарной перфузии, а во-вторых, уменьшение потребности миокарда в кислороде и уменьшение зоны некроза.
Отсутствие специфических методов лечения венозной воздушной эмболии и ПВЭ и тяжесть их течения подчеркивают важность профилактики. По данным ряда авторов [2, 14, 16, 26, 27], использование транспищеводной ЭхоКГ во время проведения оперативного вмешательства позволяет быстро обнаружить и исключить возможность появления венозной воздушной эмболии у пациентов из группы риска. Установка транспищеводного датчика и фиксация его таким образом, чтобы после перевода пациента в положение сидя на экране монитора были видны верхняя полая вена, правое предсердие и ЛЖ, позволяет вовремя выявить появление микропузырьков воздуха в кровеносном русле. Также этот метод позволяет интраоперационно определить наличие и функционирование открытого овального окна, что теоретически даст возможность снизить риск возникновения венозной и парадоксальной воздушной эмболии [2, 16]. Однако проблематичность этого рассуждения рассмотрена выше.
Разработанный Бунегиным и Элбиным метод эвакуации воздушного эмбола из правых отделов сердца через специальный многопросветный катетер является весьма эффективным в лечении ВВЭ, но корректная установка аспирационного катетера - далеко не простая процедура, которая должна проводиться в условиях рентгенологического контроля [28].
Естественно, что методы профилактики ВВЭ у нейрохирургических больных, оперируемых в положении сидя, позволяют снизить частоту и ПВЭ. Так, считается, что снижает риск возникновения ВВЭ проведение оперативного вмешательства в положении полусидя с приподнятым ножным концом операционного стола по методу S. Jadik и соавт. [29]. В этой позиции тазобедренные суставы согнуты максимально до 90°, ноги подняты кверху таким образом, что стопы пациента находятся выше его головы. Туловище максимально отклонено кзади, голова отклонена и фиксирована кпереди. При таком положении головы необходимо контролировать наличие достаточного пространства для осуществления компрессии яремных вен. Данное положение за счет повышения давления в правом предсердии также позволяет снизить риск ВВЭ. Это не единственная публикация, где за счет подъема нижних конечностей, форсированной инфузионной терапии коллоидными растворами и других хитростей авторы пытаются избежать отрицательного внутрисинусного давления [30]. В одной из таких работ вообще предлагалось надевать на больных специальные пневмокомпрессионные штаны («military anti shock trousers»), которые при инфляции выдавливают депонированную кровь из сосудов нижних конечностей [31]. Беда всех этих профилактических подходов в том, что все они весьма ограниченно эффективны и их профилактический эффект в серьезных исследованиях не подтвержден [1, 2].
Строго говоря, существуют три причины развития ВВЭ у нейрохирургических больных, оперируемых в положении сидя: 1) повреждение стенок синусов и крупных вен мозга при трепанации и доступе (практически неизбежная ситуация); 2) отсутствие защитного механизма спадения стенок поврежденных синусов и вен из-за ригидности их стенок (механизм, работающий в периферических венах); 3) отрицательное давление в венах и синусах мозга из-за постуральных эффектов кровообращения [1, 2]. Последний пункт является единственным, на который можно реально повлиять, и для этого предложено несколько методов [32].
Положительное давление в конце выдоха. Увы, метод оказался не только неэффективным, но и опасным. При высоких значениях ПДКВ эффект на величину внутрисинусного давления оказался обратным - оно снижалось, по-видимому, из-за снижения объемного мозгового кровотока [32]. В одном из исследований с помощью контрастной ЭхоКГ показано, что ПДКВ способствует переходу воздушных эмболов справа налево, т. е. повышает риск ПВЭ [33].
Надувной шейный турникет. Это простое устройство позволяет за счет наружной компрессии яремных вен на шее повысить давление в синусах мозга выше атмосферного [34]. Метод 100% эффективен, но трудоемок, так как для безопасности требует катетеризации одной из яремных вен (контроль величины венозного давления) выше уровня стояния турникета [32].
Управляемая умеренная гиперкапния. Метод был впервые описан группой немецких авторов еще в 1991 г. [35] и тоже оказался высокоэффективным, но при этом простым в реализации [32].
Однако самым эффективным методом профилактики ВВЭ у нейрохирургических больных является отказ от операций в положении сидя и переход на хирургию в положении лежа [36].
Заключение
Таким образом, венозная воздушная эмболия у пациентов с открытым овальным окном или внутрилегочным шунтированием является редким, но реально жизнеугрожающим осложнением при выполнении нейрохирургических вмешательств в положении сидя. Эффективные меры, направленные на профилактику венозной воздушной эмболии, способны снизить риск и парадоксальной эмболии, и самой эффективной из этих мер является отказ от операций в положении сидя с переходом на хирургию в положении лежа.
Конфликт интересов отсутствует.
Комментарий
Коллектив авторов приводит клиническое наблюдение развития венозной и парадоксальной воздушной эмболии у пациента с опухолью ствола головного мозга. Это очень грозное, а порой фатальное осложнение нейрохирургических операций, выполняемых у пациентов в положении сидя. В статье обсуждаются различные подходы и методы, опубликованные ранее отечественными и зарубежными исследователями, направленные как на предупреждение развития воздушно-эмболических осложнений, так и на их лечение. Обсуждаются алгоритмы пред- и интраоперационного обследования и ведения пациентов. В ходе обсуждения данного клинического наблюдения авторы приводят данные литературы о возможных причинах венозных и парадоксальных воздушных эмболий в нейрохирургической практике.
В представленном клиническом наблюдении парадоксальная воздушная эмболия, развившаяся во время проведения нейрохирургического вмешательства в положении сидя, привела к формированию острого инфаркта миокарда и нарушению мозгового кровообращения, которые в конечном итоге явились причиной гибели пациента. Авторы акцентируют внимание читателей на способах пред- и интраоперационной диагностики данных осложнений, указывая, что эффективных способов лечения венозной и парадоксальной воздушной эмболий в настоящее время не разработано. Авторы приходят к выводу, один из которых указывает на необходимость перехода к выполнению нейрохирургических вмешательств в положении лежа во всех технически возможных случаях и максимальный отказ от хирургии в положении сидя - для снижения риска развития воздушно-эмболических осложнений.
Статья может быть полезна не только нейрохирургам и анестезиологам-реаниматологам, но и всем смежным специалистам, принимающим участие в лечение пациентов с поражением головного мозга.
С.В. Свиридов (Москва)
Список литературы:
- Лубнин А.Ю., Осканова М.Ю. Воздушная эмболия при нейрохирургических вмешательствах. Вопросы нейрохирургии. 1995;4:33-38.
- Albin MS. Air embolism. In: Textbook of Neuroanesthesia with neurosurgical and neuroscience perspectives. Ed. Albin M.S. McGraw - Hill Co. NY etc. 1997;1009-1025.
- Matjasko J, Petrozza P, Cohen M, Steinberg P. Anesthesia and surgery in the seated position: analysis of 554 cases. Neurosurgery. 1985;17:695-702. doi: 10.1097/00006123-198511000-00001.
- Porter JM, Pidgeon C, Cunningham AJ. The sitting position in neurosurgery: a critical appraisal. Br J Anaesth. 1999;82:117-128. doi: 10.1097/00132586-199912000-00023.
- Fathi AR, Eshterhardi P, Meier B. Patient foramen ovale and neurosurgery in sitting position: a systematic review. Br J Anaesth. 2009;102:588-596. doi: 10.1093/bja/aep063.
- Glenski JA, Cucchiara RF, Michenfelder JD. Transesophageal echocardiography and transcutaneous O2 and CO2 monitoring for detection of venous air embolism. Anesthesiology. 1986;64:541-545. doi: 10.1097/00000542-198605000-00001.
- Arnott C, Kelly K, Wolfers D, Cranney G, Giles R. Paradoxical cardiac and cerebral arterial gas embolus during percutaneous lead extraction in a patient with a patent foramen ovale. Heart Lung Circ. 2015;24:14-17. doi: 10.1016/j.hlc.2014.09.002.
- Wośko J, Dąbrowski W, Zadora P, et al. Coronary air embolism during removal of a central venous catheter. Anaesthesiol Intensive Ther. 2012;44:21-24.
- Коновалов А.Н., Лубнин А.Ю., Осканова М.Ю. Массивная рецидивирующая венозная воздушная эмболия у больной с каверномой ствола мозга, оперированной в положении сидя (наблюдение). Вопросы нейрохирургии. 2001;2:21-23.
- Gansland O, Merkel A, Schmitt H, Tzabazis A, Buchfelder M, Eyupoglu I, Muenster T. The sitting position in neurosurgery: indications, complications and results. a single institution experience of 600 cases. Acta Neurochirurgica. 2013;155:1887-1893. doi: 10.1007/s00701-013-1822-x.
- Harrison EA, Mackersie A, McEwan A, Facer E. The sitting position for neurosurgery in children: a review of 16 years’ experience. Br J Anaesth. 2002;88:12-17. doi: 10.1093/bja/88.1.12.
- Ueda Y. A reappraisal of retrograde cerebral perfusion. Ann. Cardiothorac. Surg. 2013;2:316-325. doi: 10.3978/j.issn.2225-319X.2013.01.02.
- Mammoto T, Hayashi Y, Ohnishi Y, Kuro M. Incidence of venous and paradoxical air embolism in neurosurgical patients in the sitting position: detection by transesophageal echocardiography. Acta Anaesthesiol Scand. 1998;42:643-647. doi: 10.1111/j.1399-6576.1998.tb05295.x.
- Furuya H, Okumura F. Detection of paradoxical air embolism by trasesophageal echocardiography. Anesthesiology. 1984;60:374-377. doi: 10.1097/00000542-198404000-00020.
- Hagen PT, Scholz DG, Edwards WD. Incidence and size of patent foramen ovale during the first 10 decades of life: an autopsy study of 965 normal hearts. Mayo Clin Proc. 1984;59:17-20. doi: 10.1016/s0025-6196(12)60336-x.
- Feigl GC, Decker K, Wurms M, et al. Neurosurgical Procedures in the Semisitting Position: Evaluation of the Risk of Paradoxical Venous Air Embolism in Patients with a Patent Foramen Ovale. World Neurosurg. 2014;81:159-164. doi: 10.1016/j.wneu.2013.01.003.
- Marquez J, Sladen A, Gendell H, Boehnke M, Mendelow H. Paradoxical cerebral air embolism without an intracardiac septal defect. J Neurosurg. 1981;55:997-1000. doi: 10.3171/jns.1981.55.6.0997.
- Dankner R, Gall N, Freidman G, Arad J. Recompression treatment of red sea diving accidents; a 23 years summary. Clin J Sport Med. 2005;15:253-256. doi: 10.1097/01.jsm.0000168074.89744.4f.
- Fitchet A, Fitzpatrick AP. Cerebral venous air embolism causing pulmonary edema mimicking left ventricular failure. BMJ. 1998;16:604-606. doi: 10.1136/bmj.316.7131.604.
- Sibai AN, Baraka A, Moudawar A. Hazards of nitrous oxide administration in the presence of venous air embolism. Middle East. J Anesthesiol. 1996;13:259-271.
- Muth CM, Shank ES. Gas embolism. N Eng J Med. 2000;342:476-482. doi: 10.1056/nemj200002173420706.
- Shaikh N, Ummunisa F. Acute management of vascular air embolism. J Emerg Trauma Shock. 2009;2:180-185. doi: 10.4103/0974-2700.55330.
- Gadhinglajkar SV, Sankarkumar R, Rupa S. Retrograde cerebral perfusion for treatment of air embolism after valve surgery. Asian Cardiovasc Thorac Ann. 2004;12:81-82. doi: 10.1177/021849230401200120.
- Guy TS, Kelly MP, Cason B, Tseng E. Retrograde cerebral perfusion and delayed hyperbaric oxygen for massive air embolism during cardiac surgery. Interact Cardiovasc Thorac Surg. 2009;8:382-383. doi: 10.1510/icvts.2008.194472.
- Archer DP, Pash MP, Mackie ME. Successful management of venous air embolism with inotropic support. Neuroanesth Intensive Care. 2001;48:204-208. doi: 10.1097/00132586-200202000-00035.
- Jaffe RA, Siegel LC, Schnittger I, Propst JW, Brock-Utne JG. Epidural air injection assessed by transesophageal echocardiography. Reg Anesth. 1995;20:152-155.
- Mirski MA, Lele AV, Fitzsimmons L, Toung TJ. Diagnosis and treatment of vascular air embolism. Anesthesiology. 2007;106:164-177. doi: 10.1097/00000542-200701000-00026.
- Colley PS, Artu AA. Bunegin - Albin catheter improves air retrieval and resuscitation from lethal air embolism in up-right dogs. Anesth Analg. 1989;68:298-301. doi: 10.1213/00000539-198710000-00013.
- Jadik S, Wissing H, Friedrich K, Beck J, Seifert V, Raabe AA. A standardized protocol for the prevention of clinically relevant venous air embolism during neurosurgical interventions in semisitting position. Neurosurgery. 2009;64:533-538. doi: 10.1227/01.neu.0000338432.55235.d3.
- Perkins NAK, Bedford RF. Hemodynamic consequences of PEEP in seated neurological patients: Implications for paradoxical air embolism. Anesth Analg. 1984;63:429-432. doi: 10.1213/00000539-198404000-00009.
- Meyer PG, Cuttaree H, Charron B, Jarreau MM, Perie AC, Sainte-Rose C. Prevention of venous air embolism in paediatric neurosurgical procedures performed in the sitting position by combined use of MAST suit and PEEP. Dr J Anaesth. 1994;73:795-800. doi: 10.1093/bja/73.6.795.
- Лубнин А.Ю., Осканова М.Ю. Профилактика воздушной эмболии у нейрохирургических больных, оперируемых в положении сидя: сравнительное изучение трех методов. Анестезиология и реаниматология. 1994;5:22-26.
- Colohan AR, Perkins NA, Bedford RF, Jane JE. Intravenous fluid loading as prophylaxis for paradoxical air embolism. J Neurosurg. 1985;62:839-842. doi: 10.3171/jns.1985.62.6.0839.
- Sale JP. Prevention of air embolism during sitting neurosurgery (the use of an inflatable neck tourniquet). Anaesthesia. 1984;39:795-799. doi: 10.1111/j.1365-2044.1984.tb06527.x.
- Zentner J, Albrecht T, Hassler W. Prevention of an air embolism by moderate hypoventilation during surgery in the sitting position. Neurosurgery. 1991;28:705-708. doi: 10.1227/00006123-199105000-00011.
- Исраелян Л.А., Шиманский В.Н., Одаманов Д.А., Пошатаев В.К., Лубнин А.Ю. Положение больного на операционном столе в нейрохирургии: сидя или лежа? Анестезиология и реаниматология. 2013;4:18-26.
О журнале Редколлегия Редакционная этика Авторам Порядок рецензирования Контакты Фотографии статьи Voprosy neirokhirurgii 2016 02 10 ris1 Рис. 1. ЭКГ пациента, выполненная интраоперационно. Ритм синусовый, горизонтальная ЭОС. Элевация сегмента ST V1-V5, формирование зубца QS V1-V2. Voprosy neirokhirurgii 2016 02 10 ris2 Рис. 2. ЭКГ пациента до операции. Какая-либо патология отсутствует. Voprosy neirokhirurgii 2016 02 10 ris3 Рис. 3. Рентгенограмма органов грудной полости в прямой проекции. Тень средостения не смещена. Отмечается выраженное диффузное снижение прозрачности легочной ткани по типу «матового стекла». Voprosy neirokhirurgii 2016 02 10 ris4 Рис. 4. КТ-головного мозга пациента, выполненная сразу после операции. Отмечается выраженная пневмоцефалия. Voprosy neirokhirurgii 2016 02 10 ris5 Рис. 5. КТ-головного мозга пациента, выполненная через 12 ч после операции. Отмечается формирование выраженного отека мозгового вещества, с признаками латеральной дислокации. Остаточная пневмоцефалия. Снижение дифференцировки серого и белого вещества.






