НИИ нейрохирургии им. акад. Н.Н. Бурденко
Введение
С момента внедрения непрерывного измерения внутричерепного давления (ВЧД) Lundberg описал особый тип волн [1]. Отличительной особенностью данных волн было внезапное повышение до 50-100 мм рт.ст. и характерное уплощение по тренду волны. Волны ВЧД с характерной формой появлялись внезапно и сохранялись от нескольких минут до часов, а затем самостоятельно разрешались [2,3]. Lundberg назвал их волнами «А». В литературе данный тип волн чаще упоминается, как плато волны или волны Лундберга [2,3,4,5].
Патофизиологический механизм развития плато волн был описан в эксперименте на животных и подтвержден в клинической практике Rosner and Becker [6]. В основе развития плато волн лежит вазодилатация резистивных сосудов головного мозга, которая приводит к увеличению его кровенаполнения и, как следствие, повышению ВЧД [6,7,8,9].
В клинической практике развитие плато волн описано у пациентов с различной церебральной патологией: травматическим повреждением головного мозга, субарахноидальным кровоизлиянием, краниостенозом, опухолями мозга, гидроцефалией [7-13]. Причины повышения ВЧД при тяжелой ЧМТ хорошо известны: отек мозга, увеличение кровенаполнения мозга, нарушении венозного оттока, нарушение ликвородинамики и др. [2-5,8,9]. Большинство из них диагностируется и оценивается в динамике с помощью КТ [14-18]. Однако, вазогенный фактор [9,19], как еще одна причина внутричерепной гипертензии - не поддается адекватной компьютерно-томографичекой оценке, но доступен диагностике с помощью непрерывного измерения ВЧД с использованием компьютерного анализа [19,20,21]. В клинической практике встречаются ситуации, когда высокие значения ВЧД не соответствуют тяжести первичного церебрального повреждения и не соответствуют рентгенологической картине нарушения внутричерепных взаимоотношений по данным КТ [2,8]. На фоне сохранности ликворных пространств и охватывающей цистерны у пациентов могут регистрироваться повторные эпизоды повышения ВЧД [4,5,8]. Для определения частоты развития, причин развития данного вида волн, а так же влияния на исход мы провели это исследование.
Материалы и методы исследования
Проведен ретроспективный анализ 98 пострадавших с тяжелой ЧМТ, находивщихся на лечении в отделении реанимации и интенсивной терапии НИИ нейрохирургии им. Н.Н. Бурденко в период с 2007 по 2011 год, которым проводился мониторинг АД, ВЧД, ЦПД. Данные сохранялись, анализировались и рассчитывались с помощью программного обеспечения ICM Plus [21]. В отделении реанимации и интенсивной терапии больным проводились ИВЛ, РаСО2 поддерживалось на уровне 30 - 35 мм рт. ст., Ра02 не ниже 100 мм рт. ст., проводилась седация, анальгезия (пропофол 1 - 3 мг/кг/ч или мидазолам 10 - 30 мкг/кг/ч, фентанил 1-2 мкг/кг/ч). ЦПД поддерживалось выше 60 мм рт. ст., при ВЧД выше 20 мм рт. ст. использовали болюсное введение 15% маннитола (0,25 - 1 г/кг) или Гиперхаес 2-3 мл/кг. Мониторинг АД проводился с помощью прямого измерения через артериальный катетер, установленный в лучевой артерии, тыльной артерии стопы или бедренной артерии. Мониторинг ВЧД проводился с помощью монитора ICP Express Monitor Codman и датчика Codman MicroSensor (Jonson@Jonson Professional, Inc., Raynham, US). Показания для мониторинга ВЧД. Мониторинг ВЧД является рутиной методикой при ведении пациентов с тяжелой ЧМТ. Согласно Международному протоколу ведения пострадавших с ЧМТ [22] имплантация датчиков ВЧД проводится у пострадавших с тяжестью состояния, оцениваемой по шкале комы Глазго (ШКГ), меньше 8 балов, при наличии патологических изменении в головном мозге по данным компьютерной томографии (КТ). При отсутствии патологических изменений на КТ имплантация датчика проводится при наличии любых 2 из перечисленных критериев: возраст старше 40 лет; АД систолическое менее 90 мм рт.ст., наличие позно-тонических реакций (декортикация или децеребрация). Имплантация датчика ВЧД проводилась в условиях операционной или реанимационного отделения. Датчик ВЧД имплантировался в белое вещество мозга на глубину 2см. Датчик имплантировался через трефинационное отверстие в проекции точки Кохера в премоторную зону по общепринятой методике. Сторона имплантации выбиралась в зависимости от характера повреждения. При диффузном поражении датчик имплантировался в недоминатное полушарие. При очаговом поражении со стороны большего повреждения мозгового вещества. Калибровка датчика ВЧД проводилась согласно инструкции производителя на поверхности стерильного физиологического раствора на границе вода-воздух. Референсное значение (калибровочное число) регистрировалось на датчике ВЧД. Волна ВЧД представляет собой сложную кривую, которая состоит из трех основных компонентов, перекрывающихся во временном диапазоне. Для детального анализа эти компоненты ВЧД можно выделить с помощью анализа Фурье (анализ частотно-временных характеристик) [23]. В результате анализа были выделены три компонента: основной компонент соответствовал частоте сердечных сокращений. Амплитуда основного компонента обозначалась как АМП и сохранялась для дальнейшего расчета коэффициентов. Второй компонент представлял респираторную волну, которая характеризует дыхательный цикл с частотой 8 – 20 в минуту. Третий компонент объединял «медленные волны», которые включают волновые колебания в диапазоне 0,05–0,0055 Hz (с периодом от 20 сек до 3 минут). Величина каждого из этих компонентов рассчитывалась как квадратный корень из мощности общего сигнала ВЧД в данном диапазоне частот. Дополнительно проводился расчет корреляционных индексов отражающих резерв пространственной компенсации внутри черепа, церебральную ауторегуляцию. RAP индекс пространственной компенсации – корреляционный коэффициент между АМП (амплитудой основного компонента) и средним ВЧД. Расчет проводился линейной корреляцией 40 последовательных усредненных измерений АМП и среднего ВЧД с периодом 6 секунд. RAP индекс отражает корреляционную зависимость между АМП и средним ВЧД за короткий промежуток времени равный 4 минутам ( 40 x 6 сек). Коэффициент корреляции 0 свидетельствует о хорошем компенсаторном резерве. Коэффициент корреляции + 1 указывает на сниженную пространственную компенсацию. Отрицательные значения RAP указывают на срыв компенсаторных резервов и коллапс сосудов. RAP – коэффициент, указывающий расположение на кривой объем-давление – кривой комплайнса. Prx – это коэффициент корреляции между средним АД и средним ВЧД. Расчет проводился по аналогичной методике с использование расчета линейной корреляции, между 40 последовательными усредненными измерениями среднего АД и среднего ВЧД. Использовался скользящий коэффициент корреляции с периодом 6 секунд. Положительный коэффициент корреляции говорит о нарушенной ауторегуляции, отрицательный коэффициент о сохранной ауторегуляции. Плато волны ВЧД определялись при ретроспективном анализе трендов АД, ВЧД, ЦПД. Плато волной считали неспровоцированное повышение ВЧД > 40 мм рт.ст. длительностью свыше 5 минут при условии стабильного АД и снижения ЦПД < 50 мм рт.ст. (Рис.1,2,3).
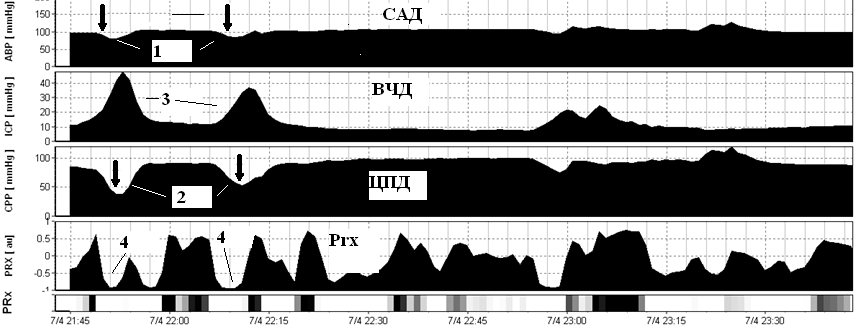
Отличительной особенностью вазогенных волн от плато волн является отрицательный коэффициент Prx в момент повышения ВЧД, что свидетельствует о противофазе изменения САД и ВЧД. 1 - эпизод снижения САД, который предшествует формированию вазогенной волне ВЧД. 2 - эпизод снижение ЦПД, который следует сразу за снижением САД и прогрессивно нарастает при повышении ВЧД. 3- вазогенная волна ВЧД. Prx – коэффициент ауторегуляции.
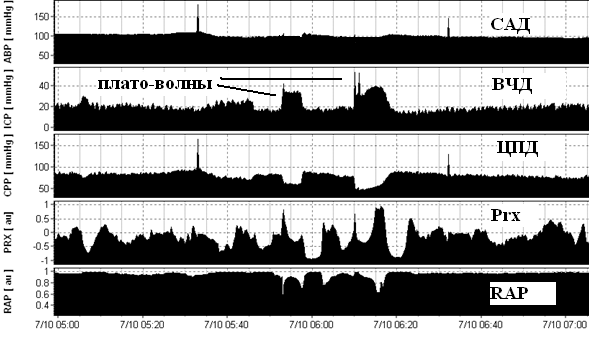
Плато-волны ВЧД имеют уплощённую вершину, формируются на фоне относительно стабильного САД, сопровождаются значительным снижением ЦПД до 50 и ниже мм рт.ст. Важным условием появления плато волн ВЧД является наличие сохранной ауторегуляции мозговых сосудов (Prx <0) и сниженных резервов пространственной компенсации (RAP> 0,6). В момент формирования плато волн развивается максимальная вазодилатация артериол и ауторегуляция утрачивается, что регистрируется ростом Prx. САД – среднее артериальное давление, ВЧД – внутричерепное давление, ЦПД – церебрально-перфузионное давление, Prx – коэффициент ауторегуляции, RAP – коэффициент пространственной компенсации.
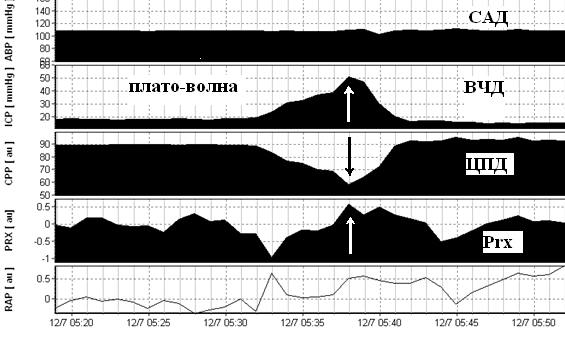
Формирование плато-волны ВЧД на фоне относительно стабильной гемодинамики. Максимальное значение плато волны 50 мм рт.ст., длительностью до 11 минут. Снижение ЦПД до 58 мм рт.ст. САД – среднее артериальное давление, ВЧД – внутричерепное давление, ЦПД – церебрально-перфузионное давление, Prx – коэффициент ауторегуляции.
Из анализа исключались все эпизоды повышения ВЧД спровоцированные санацией ТБД, ноцицептивными и проприоцептивными стимулами, изменением параметров вентиляции, колебаниями АД, изменением температуры тела. Отбор и анализ плато-волн проводился ретроспективно при ручном анализе трендов отдельно взятого пациента. Для оценки КТ-признаков диффузного аксонального повреждения (ДАП) головного мозга использовали классификацию Marshall L. [24], согласно которой выделено 4 степени ДАП: I – отсутствие видимых паренхиматозных повреждений; II – паренхиматозные повреждения высокой и смешанной плотности < 25 см3, мезенцефалические цистерны визуализируются, смещение срединных структур <5мм; III – паренхиматозное повреждение высокой и смешанной плотности < 25 см3, увеличение объема мозга с компрессией или отсутствием цистерн, смещение срединных структур < 5 мм; IV – паренхиматозное повреждение разной плотности > 25 см3, смещение > 5 мм, цистерны не визуализируются. Статистическая обработка проводилась с помощью программного пакета Статистика 6.0. Для сравнения групп использовался метод непараметрической статистики Манн - Уитни (Mann–Whitney U) тест. Для оценки отличий между группами по клиническим данным, возрасту, полу и классификации использовался тест Хи-квадрат. Каждый отдельный эпизод развития плато волны оценивался сравнением медиан парным непараметрическим тестом Вилконсона, сравнение проводилось по каждому параметру за период 20 минут до развития, во время и за период 20 минут после разрешения плато волны. Различия сравниваемых величин считались достоверными при р менее 0,05.
Результаты исследования и их обсуждение
Из анализируемых трендов 98 пострадавших с тяжелой ЧМТ, согласно принятым критериям, плато-волны были выявлены у 24 пациентов (25,5%). Средний возраст всех пострадавших составил 34+/-13,6 лет. Соотношение женщин и мужчин составило 26 : 73. ШКГ составила 6+/- 1,4 баллов. Типичный эпизод плато-волн представлен на рисунках 2 и 3. Для группы с плато волнами данные представлены в виде медианы и квартиль [25 и 75%]: количество регистрируемых плато волн 7 [3,5; 10] за время мониторинга, плато волны регистрировались на 3 [2; 4,5] сутки, максимальное значение ВЧД при развитии плато-волн 47,5 [40; 53] мм рт.ст, длительность плато волн составила 8,5 [7; 27] мин. Сравнение групп пациентов, у которых регистрировались и отсутствовали плато-волны ВЧД. Сравнение клинических характеристик и параметров мониторинга пациентов, у которых регистрировались и отсутствовали плато-волны ВЧД представлено в Табл. № 1.
Таблица 1.
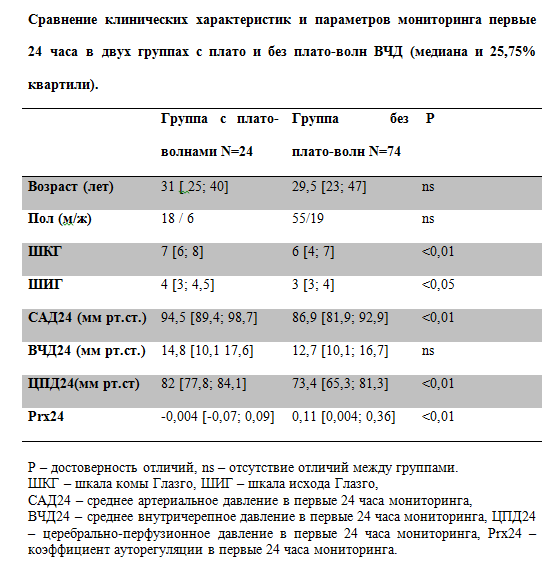
Из представленной таблицы видно, что не было отличий между группами по полу и возрасту. Группа с плато волнами ВЧД отличалась меньшей тяжестью травмы, оцененной по ШКГ в момент госпитализации и более лучшими исходами. Для объективной оценки динамики параметров мониторинга в группах мы провели сравнение, как за все время мониторинга, так и в первые 24 часа с момента госпитализации. Сравнение параметров мониторинга первые 24 часа. Группа с плато волнами ВЧД отличалась более высокими значениями САД и ЦПД первые 24 часа с момента госпитализации (Табл. №1). Это объясняется целенаправленным управлением гемодинамикой и поддержанием ЦПД выше 70 мм рт.ст. при сохранных механизмах ауторегуляции мозговых сосудов. В группе с плато волнами коэффициент Prx в первые 24 часа был достоверно ниже, что свидетельствует о сохранности церебральной ауторегуляции и адекватном ответе церебральных сосудов в ответ на повышение ЦПД. Сравнение параметров церебрального мониторинга в двух группах за все время мониторинга.
Таблица 2
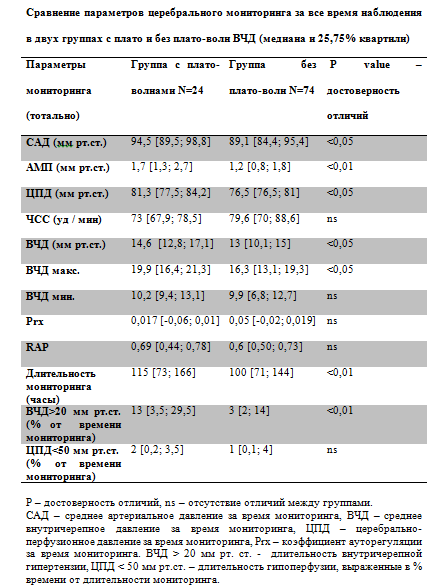
Из Табл. № 2 видно, что сохраняется достоверность отличий между группами по значениям САД, ЦПД и ВЧД. Отличия выявляются и по средним и по максимальным значениям ВЧД. На наш взгляд, это объясняется развитием плато волн в первой группе. Феномен плато волн объясняет большую продолжительность регистрации внутричерепной гипертензии в первой группе и вынужденную необходимость продления мониторинга ВЧД. Следует отметить, что группы не различались по длительности церебральной гипоперфузии (ЦПД < 50 мм рт.ст.). Это объясняется строгим контролем АД и ЦПД в обеих группах с использованием катехоламинов и инфузионной терапии. Сравнение групп по типу, виду и характеру повреждения, а также данным КТ.
Таблица №3
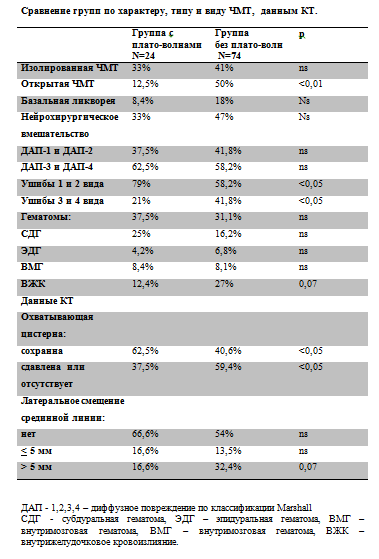
Как видно из Табл. № 3, группа пострадавших с плато волнами ВЧД отличалась достоверно меньшей частотой открытой ЧМТ (12,5%), меньшей тяжестью очагового поражения с преобладанием очагов ушиба 1-2 вида (79%). Более легкий тип первичного церебрального повреждения в группе с плато волнами соответствует ШКГ и данным КТ, которые оценивались в момент госпитализации пациентов. Так в группе с плато волнами ВЧД реже встречаются признаки дислокации. Грубая латеральная дислокация в группе с плато волнами ВЧД встречается только в 16,6%. Динамика параметров церебрального мониторинга до, во время и после развития плато волн ВЧД. Приведенная Табл. № 4 наглядно демонстрирует патофизиологический механизм формирования плато волн ВЧД.
Таблица № 4
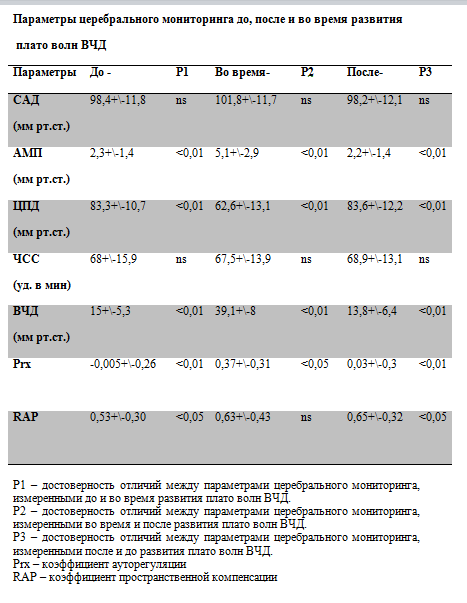
При сравнении динамики САД не выявлено достоверных отличий до, после и во время развития плато волны ВЧД. Данное свойство принципиально отличает плато волны ВЧД от эпизодов повышения ВЧД вазогенного характера (рис. 1). Несмотря на то, что в основе формирования вазогенных и плато волн лежит вазодилатация церебральных резистивных сосудов, принципиальным отличием плато волн является «спонтанный» характер их развития и характерная форма волны ВЧД. В отличие от плато волн, при вазогенных волнах ВЧД, пусковым механизмом являются эпизоды снижения САД. При плато волнах наблюдается вторичное снижение ЦПД на фоне спонтанного повышения ВЧД при стабильном АД.
На Рис. 4 представлены графики динамики параметров церебрального мониторинга до, после и во время развития плато волн.
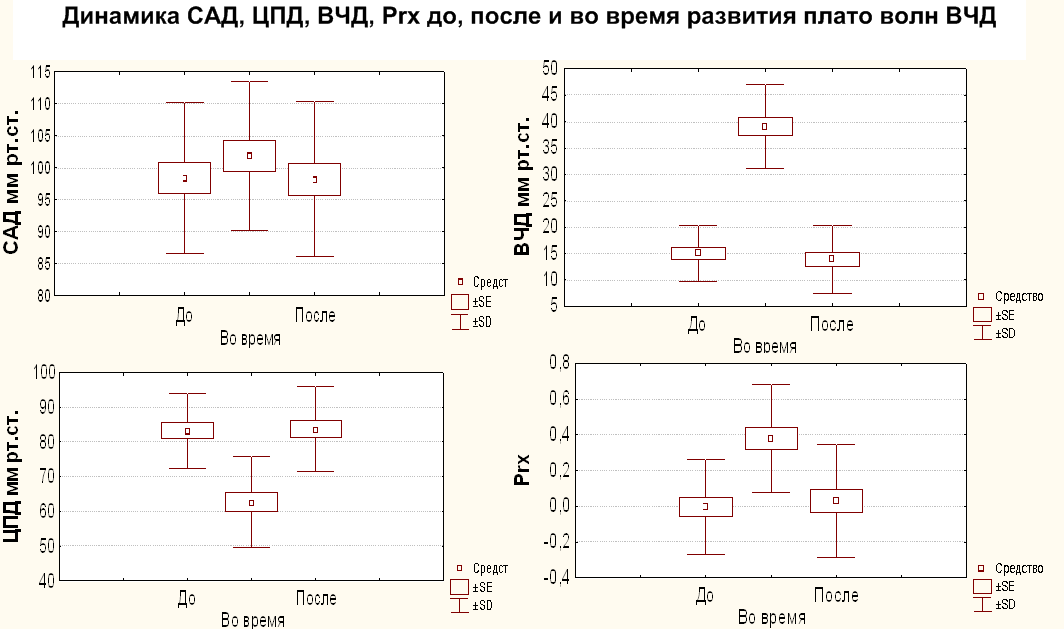
САД – среднее артериальное давление, ВЧД – внутричерепное давление. ЦПД – церебрально-перфузионное давление, Prx – коэффициент ауторегуляции.
Среднее АД достоверно не отличалось ни на одном из этапов развития плато волн. Прослеживается легкая тенденция к повышению САД в момент формирования плато волны ВЧД, что можно объяснять вазопрессорной реакций со стороны стволовых структур в ответ на снижение ЦПД или результатом лечебных мероприятий (инфузия гиперосмолярных растворов, использование вазопрессоров и др.).
Хорошо представлены разнонаправленные изменения ВЧД и ЦПД во время развития плато волн, причем у части пациентов ЦПД снижалось до ишемического уровня, т.е. до 50 мм рт.ст. У всех пациентов во время формирования плато волн регистрируется достоверное повышение Prx, которое подтверждает вазодилатацию церебральных сосудов на пике плато волн. Следует обратить внимание, что как до, так и после плато волн, ауторегуляция мозговых сосудов оставалась в норме.
Каскад вазодилатации, вазоконстрикции и плато волны ВЧД. Большинство эпизодов повышения ВЧД можно отнести к вазогенным волнам ВЧД [19,25]. Это означает, что церебральные сосуды, изменяя свой диаметр и емкость, обеспечивают увеличение объема кровенаполнения головного мозга и, тем самым, принимают участие в формировании внутричерепной гипертензии. Особенно, колебания внутричерепного кровенаполнения влияют на изменение ВЧД в условиях снижения пространственной компенсации, т.е. при сниженном комплайнсе внутричерепного пространства: отеке мозга, нарушении ликвородинамики, гидроцефалии, наличии масс - эффекта, нарушении венозного оттока [2,3,9,11,16,17,18].
Общеизвестно, что в основе любых вазогенных волн лежит каскад вазодилатации и вазоконстриции. В ответ на снижение АД и ЦПД происходит расширение резистивных сосудов, что вызывает повышение ВЧД [2,5,6,8,9].
Следует помнить, что при сохранной ауторегуляции реакция резистивных сосудов развивается с некоторым запаздыванием от 5 до 15 секунд [9,26,27,28]. Если стимул достаточно короткий по времени и сильный по амплитуде, то адекватный ауторегуляторный ответ не успевает развиться и происходит пассивное расширение или сужение артериол вслед за изменением АД, что приводит к резким перепадам объема кровенаполнения мозга и стремительным однонаправленным изменениям ВЧД. Аналогичные однонаправленные изменения АД и ВЧД наблюдаются при утраченной ауторегуляции. Так ВЧД быстро растет при резком повышении АД или, наоборот, быстро снижается ВЧД при развитии внезапной артериальной гипотонии [6].
В отличие от выше перечисленных вазогенных волн, плато волны ВЧД следует выделять из данной категории волн ВЧД, так как они развиваются внезапно при отсутствии колебаний АД [1,2,4,6,29]. Снижение ЦПД происходит вторично (при стабильном АД) от резкого повышения ВЧД. В классическом варианте плато волны характеризуются внезапным значительным повышением ВЧД, которое не связано со снижением АД и имеет уплощение на вершине тренда ВЧД [1,4,6]. Высокие значения ВЧД могут сохраняться длительно, пока существует максимальная вазодилатация артериол. Характерно, что по трендам ВЧД в этот момент регистрируется плато волны – уплощение на вершине [1-4]. Если снижение ЦПД достигает «ишемического уровня», т.е. ниже 50 мм рт.ст., то развивается рефлекс Кушинга с резким повышением АД. Высокое давление нормализует мозговой кровоток, прерывает каскад вазодилатации и запускает каскад вазоконстрикции, что быстро устраняет плато волну ВЧД.
Чаще всего плато волны регистрируется в первые сутки после травмы [1,2,4,8,9]. В нашем исследовании плато волны появлялись у большинства пациентов между 2 - 4 сутками после травмы. На наш взгляд это объясняется несколькими причинами. Во-первых, данный период является благоприятным с патофизиологической точки зрения для формирования плато волн: регистрируется сохранная ауторегуляция мозговых сосудов, снижаются резервы пространственной компенсации на фоне отека головного мозга. Снижение пространственной компенсации для пациентов первой группы (с плато волнами ВЧД) подтверждается по данным КТ наличием компрессии охватывающей цистерны, а так же по данным церебрального мониторинга, в виде наличия достоверно высоких значений амплитуды ВЧД (таблица № 2). Однако, как указывалось в предыдущих исследованиях, появление плато волн ВЧД чаще встречается на фоне закрытой травмы и при минимальном первичном церебральном повреждении [4,29]. В нашем исследовании это были пациенты преимущественно с ДАП 1-2 и очаговым поражением в виде очагов 1-2 вида.
Следует обратить внимание, что у пациентов, у которых имеется открытая ЧМТ и признаки ликвореи, реже регистрируется плато волны. На наш взгляд отрытая травма подразумевает большую степень первичного поражения. В пользу тяжести состояния свидетельствует более низкий уровень по ШКГ во второй группе. Отсутствие плато волн в этой группе также может объясняться большим процентом базальной ликвореи. Важный аспект, который может дополнительно объяснить отсутствие плато волн у более тяжелых пациентов, это большая частота нейрохирургических вмешательств, с выполнением резекционной и декомпрессивной краниотомии, что само по себе является методом устранения высокого ВЧД.
Развитие плато волн ВЧД и исход при тяжелой ЧМТ. Как показал проведенный анализ (таблица № 4)
развитие плато волн не влияет на исход у пациентов с тяжелой ЧМТ. Группа с развитием плато волн ВЧД имеет лучшие исходы. Сам патофизиологический феномен формирования плато волн требует сохранной ауторегуляции [4,29]. В нашем наблюдении в группе с плато волнами ауторегуляция была сохранная у большинства пациентов, что является гарантом адекватной сосудистой реакции. Из литературных источников известно, что сам факт сохранной ауторегуляции является важным прогностическим фактором и увеличивает вероятность благоприятного исхода при травме головного мозга [30,31]. Мы оценили влияния отдельных параметров (выраженность повышения ВЧД, длительность плато волн, количество плато волн у пациента, время возникновения плато волн) плато волн на исход ЧМТ. Корреляционный анализ не выявил зависимости между приведенными параметрами и исходом. Отсутствие влияния на исход можно объяснить тем, что мы не допускали значительных и более важно продолжительных эпизодов гипоперфузии ни в одной из групп.
Заключение
Частота развития плато волн в нашем исследовании составила 25,5%. Плато волны ВЧД чаще регистрируются при сохранной ауторегуляции мозговых сосудов, меньшей тяжести первичного повреждения. Феномен плато волн ВЧД не ухудшает исходы среди пациентов с тяжелой ЧМТ.
Список литературы
1.Lundberg N. Continuous recording and control of ventricular fluid pressure in neurosurgical practice. Acta Psychiatr. Neurol. Scand. 1960; 36 (Suppl 149):1–193.
2.Сировский Э.Б. Внутричерепная дистензия у нейрохирургических больных в раннем послеоперационном периоде: Автореф. дис. …док.мед.наук. М., 1984.
3.Маневич А.З., Салалыкин В.И. Нейро-анестезиология. М.: Медицина; 1977.
4.Czosnyka M., Smielewski P., Piechnik S., Schmidt E.A., Al-Rawi P.G., Kirkpatrick P.J.et al. Hemodynamic characterization of intracranial pressure plateau waves in head injured patients. J. Neurosurg. 1999; 91: 11–19.
5.Rosner M.J. Pathophysiology and management of increased intracranial pressure, in Andrews BT (ed): Neurosurgical Intensive Care. New York: McGraw Hill, 1993, pp 57–112
6.Rosner M.J., Becker D.P. Origin and evolution of plateau waves. Experimental observations and a theoretical model. J. Neurosurg. 1984; 60: 312–324.
7.Hayashi M., Kobayashi H., Kawano H., Yamamoto S., Maeda T. Cerebral blood flow and ICP patterns in patients with communicating hydrocephalus after aneurysm rupture. J. Neurosurg. 1984; 61: 30–36.
8.Мухаметжанов Х. Внутричерепная гипертензия в остром периоде тяжелой черепно-мозговой травмы: ( По данным клиники, компьютерной томографии и контроля внутричерепного давления): Автореф. дис. …канд.мед.наук: М., 1987.
9.Шахнович А.Р., Шахнович В.А. Диагностика нарушений мозгового кровообращения. Транскраниальная допплерография. Москва, 1996; 446.
10.Hayashi M., Kobayashi H., Kawano H., Handa Y., Yamamoto S., Kitano T. ICP patterns and isotope cisternography in patients with communicating hydrocephalus following rupture of intracranial aneurysm. J. Neurosurg. 1985; 62: 220–226.
11.Renier D., Sainte-Rose C., Marchac D., Hirsch J.F. Intracranial pressure in craniostenosis. J. Neurosurg. 1982; 57: 370–377.
12.Matsuda M., Yoneda S., Handa H., Gotoh H. Cerebral hemodynamics changes during plateau waves in brain-tumor patients. J. Neurosurg. 1979; 50: 483–488.
13.Gjerris F., Børgesen S.E., Hoppe E., Boesen F., Nordenbo A.M. The conductance to outflow of CSF in adults with high-pressure hydrocephalus. Acta Neurochir. 1982; 64:59–67.
14.Амчеславский В.Г. Интенсивная терапия вторичных повреждений головного мозга в остром периоде черепно-мозговой травмы: Автореф. …докт.мед.наук. М., 2002.
15.Гайтур Е.И. Вторичные механизмы повреждения головного мозга при черепно-мозговой травме (диагностика, тактика лечения и прогноз): Автореф. дис. ...док. мед наук. М., 1999.
16.Корниенко В.Н., Потапов А.А., Пронин И.Н., Захарова Н.Е. Диагностические возможности компьютерной и магнитно-резонансной томографии при черепно-мозговой травме. В кн.: Доказательная нейротравматология. Под ред. А.А. Потапова и соавт. М. 2003; 408-461.
17.Потапов А.А. Патогенез и дифференцированное лечение очаговых и диффузных поражений головного мозга: Автореф. дис. …док.мед.наук. М., 1989.
18.Потапов А.А., Захарова Н.Е., Пронин В.Н., Корниенко В.Н., Гаврилов А.Г., Кравчук А.Д. и др. Прогностическое значение мониторинга внутричерепного давления и церебрально-перфузионного давления, показателей регионарного кровотока при диффузных и очаговых повреждения мозга. Вопросы нейрохирургии.2011, 3: 3-18.
19.Czosnyka M., Richards H.K., Czosnyka Z., Piechnik S., Pickard J.D., Chir M. Vascular components of cerebrospinal fluid compensation. J. Neurosurg. 1999; 90: 752–759.
20.Шевчиковский Е., Шахнович А.Р., Коновалов А.Н и др. Использование ЭВМ для интенсивного наблюдения за состоянием больных в нейрохирургической клинике. Вопр.нейрохир.1980,3: 7-16.
21.Smielewski P., Czosnyka M., Steiner L., Belestri M., Piechnik S., Pickard J.D. ICM+: software for on-line analysis of bedside monitoring data after severe head trauma. Acta Neurochir. Suppl. (Wien) 2005; 95:43–9.
22.The Brain Trauma Foundation. The American Association of Neurological Surgeons. The Joint Section on Neurotrauma and Critical Care. Indications for intracranial pressure monitoring. J. Neurotrauma 2000; 17(6-7): 479-491.
23.Czosnyka M., Pickard J.D. Monitoring and interpretation of intracranial pressure. J Neurol. Neurosurg. Psychiatry 2004; 75: 813–821.
24.Marshall L.F., Marshall S.B., Klauber M.R., van Berkum Clark M, Eisenberg H.M. et al. A new classification of head injury based on computerized tomography. J. Neurosurg. 1991; 75 (Suppl.):S14–S20.
25.Marmarou A., Maset A.L., Ward J.D., Choi S., Brooks D., Lutz H.A., et al. Contribution of CSF and vascular factors to elevation of ICP in severely head-injured patients. J. Neurosurg. 1987; 66: 883–890.
26.Kontos H.A. Regulation of the cerebral circulation. Annu Rev. Physiol. 1981; 43: 397-407.
27.Kontos H.A., Wei E.P., Navari R.M., Levasseur J.E., Rosenblum W.I., Patterson J.L.Jr. Responses of cerebral arteries and arterioles to acute hypotension and hypertension. Am J. Physiol. 1978; 234:H371-H383.
28.Kontos H.A., Wei E.P., Raper A. J., Rosenblum W.I., Navari R.M., Patterson J.L .Jr. Role of tissue hypoxia in local regulation of cerebral microcirculation. Am. J. Physiol. 1978; 234: H582-H59 l.
29.Castellani G., Zweifel C., Kim D.J., Carrera E., Radolovich D.K., Smielewski P., et al. Plateau waves in head injured patients requiring neurocritical care. Neurocrit. Care. 2009; 11(2): 143-50.
30.Sorrentino E., Diedler J., Kasprowicz M., Budohoski K.P., Haubrich C., Smielewski P. et al. Critical thresholds for cerebrovascular reactivity after traumatic brain injury. Neurocrit. Care. 2012 Apr; 16(2): 258-66.
31.Zweifel C., Lavinio A., Steiner L.A., Radolovich D., Smielewski P., Timofeev I.et al. Continuous monitoring of cerebrovascular pressure reactivity in patients with head injury. Neurosurg. Focus. 2008 Oct; 25(4): E2.






