НИИ Нейрохирургии им Н.Н. Бурденко, РАМН, Москва
Введение
Диэнцефальные структуры (ДС) включает в себя таламус, гипоталамус, эпиталамус, субталамус и гипофиз [1]. Таламус, располагаясь ниже боковых желудочков, представляет собою скопление ядер, имеет овальную форму, образует боковую стенку III желудочка и занимает 4/5 пространства диэнцефальной области. Основной функцией таламуса является первичный анализ и передача информации коре мозга от всех органов чувств за исключением обонятельного анализатора. Гипоталамус – это комплекс ядер, которые формируют дно и боковые стенки III желудочка.
Выделяют паравентрикулярное, супраоптическое, преоптическое, супрахиазматическое, вентромедиальное, аркуатное, маммиллярное, заднее и другие ядра. Ядра гипоталамуса имеют обширные интракраниальные связи. В гипоталамусе синтезируются пептиды – либерины и статины. Гипоталамус является высшим центром эндокринной регуляции, обеспечивает постоянство внутренней среды организма, регулирует функционирование органов и систем организма, координирует работу нервной, эндокринной и иммунной систем. Эпиталамус - шишковидное тело, поводок, его ядра и спайки, задняя комиссура - образуют крышу III желудочка, к которой прилежит сосудистое сплетение.
В шишковидном теле синтезируется мелатонин. Эпиталамус регулирует цикл сон-бодрствование, принимает участие в регуляции эмоций и работы автономной нервной системы. Субталамус включает в себя субталамическое ядро, ростральные отделы красного ядра и черной субстанции, располагается между таламусом и покрышкой среднего мозга и участвует в экстрапирамидной регуляции движений. Гипофиз расположен в турецком седле клиновидной кости и имеет две доли – переднюю (аденогипофиз) и заднюю (нейрогипофиз). Нейрогипофиз соединен с гипоталамусом ножкой гипофиза, которая представляет собою аксоны нейронов ядер гипоталамуса и эпиталамуса и по которой транспортируется вазопрессин, окситоцин и мелатонин. В передней доле гипофиза синтезируются тропные гормоны (адренокортикотропный, тиреотропный, гонадотропный, соматотропный гормоны и пролактин), выделение которых регулируется гипоталамическими пептидами. Либерины и статины поступают в аденогипофиз из гипоталамуса по разветвленной системе артериол, капилляров и венул. Эндокринная регуляция является основной функцией гипофиза.
Описаны синдромы, развивающиеся вследствие повреждения ДС: диэнцефальная дистермия (гипертермия, гипотермия, пойкилотермия), гипоталамическое ожирение, диэнцефальный синдром детей, гипоталамическая кахексия взрослых, анорексия, булимия, диэнцефальная глюкозурия, акромегалия, болезнь Кушинга, гипоталамический гипогонадизм, гипофизарный нанизм, гигантизм, синдром Прадера-Вилли и другие [2,3]. У нейрореанимационных пациентов с черепно-мозговой травмой признаки повреждения ДС выявляются в 15-33% наблюдений [4 – 6]. Спектр клинических проявлений, которые эти авторы считают последствием повреждения ДС, у пациентов с черепно-мозговой травмой широк и включает в себя нарушение сознания, расширение зрачков, повышение внутричерепного давления, артериальную гипертензию, тахикардию, брадикардию или другие нарушения сердечного ритма, лихорадку, повышение мышечного тонуса, опистотонус, гипергидроз, тахипноэ. Учитывая механизмы повреждения мозга при черепно-мозговой травме, сложно говорить об изолированном повреждении ДС у этой категории пациентов. Ряд вышеперечисленных симптомов является следствием первичного повреждения стволовых и подкорковых структур или дислокации ствола мозга.
У пациентов с опухолями хиазмально-селлярной области (ХСО) и осложненным течением послеоперационного периода критическое состояние обусловлено изолированным повреждением ДС. При этом формируется характерный синдром - синдром диэнцефальной дисфункции (СДД).
Цель исследования
Описание СДД у реанимационных пациентов. В связи с поставленной целью было необходимо решить следующие задачи: определить структуру СДД; определить варианты СДД; провести корреляцию между вариантом СДД и исходом заболевания.
Материалы и методы исследования
В исследование вошли пациенты, оперировавшиеся в Институте в период с 2006 года по 2009 год, включительно. Критериями включения были: Возраст старше 18 лет; опухоль ХСО; осложненное течение раннего (7 суток) послеоперационного периода; пребывание пациента в отделении реанимации более 48 часов. Критериями исключения были: пребывание пациента в отделении реанимации менее 48 часов; интракраниальные осложнения, не связанные с повреждением диэнцефальных структур (оболочечные гематомы, внутримозговые гематомы на отдалении от ложа удаленной опухоли, ишемическое повреждение мозга в бассейне магистральных сосудов мозга); атоническая кома, развившаяся в течение 7 суток после операции; тромбоэмболия легочной артерии и острый инфаркт миокарда, развившиеся в течение 7 суток после операции; сепсис, развившийся в течение 7 суток после операции. Регистрировались проявления полиорганной дисфункции. Для этого использовались критерии шкалы SOFA [7]. Исключениями стала квалификация измененного сознания (ИС) и дисфункции дыхательной системы. Сознание оценивалось по шкале RASS (Таблица №1).

Шкала RASS была выбрана, поскольку у изучаемой группы пациентов развивается как угнетение сознания, так и психомоторное возбуждение. В этих условиях использование других общепринятых шкал, оценивающих уровень сознания, в том числе и шкалы ком Глазго, не охватывало всех изменений сознания, характерных для пациентов с опухолями ХСО при осложненном течении послеоперационного периода. Отсутствие ИС соответствовало оценке RASS 0, при любой другой оценке RASS сознание считалось измененным.
Критериями дисфункции дыхательной системы являлись снижение индекса pO2/FiO2 ниже 400, как в шкале SOFA, и необходимость проведения продленной ИВЛ (более 24 часов после операции). Это связано с тем, что причиной дыхательной дисфункции у нейрореанимационных пациентов является не только паренхиматозное повреждение легких, которое отражает pO2/FiO2 индекс, но и другие механизмы, например, нарушение центральных механизмов регуляции дыхания или угнетение сознания [8]. Другие соматические органные дисфункции (СОД) квалифицировались строго в соответствии со шкалой SOFA. Дисфункция сердечно-сосудистой системы определялась как развитие артериальной гипотензии (снижение среднего АД ниже 70 мм.рт.ст.) или необходимость использования симпатомиметических препаратов. Почечная дисфункция определялась как повышение уровня креатинина выше 110 мкмоль/л или при снижении диуреза менее 500 мл/сут. Печеночная дисфункция определялась как повышение уровня билирубина выше 20 мкмоль/л. Гематологическая дисфункция определялась как тромбоцитопения (менее 150 тыс/мкл).
Водно-электролитные нарушения (ВЭН) и кишечная дисфункция часто развиваются у пациентов с опухолями ХСО и осложненным течением послеоперационного периода. Шкала SOFA не включает оценку этих нарушения, поэтому были введены следующие квалифицирующие их критерии. ВЭН определялись как диснатриемия (повышение выше 145 ммоль/л или снижение ниже 135 ммоль/л) вследствие несахарного диабета, синдрома неадекватной секреции вазопрессина или сольтеряющего синдрома. Кишечная дисфункция определялась как парез ЖКТ. Лихорадка определялась как повышение температуры тела выше 38,5ºС, гипотермия – снижение температуры тела ниже 36ºС. Для предупреждения развития гормональной недостаточности все пациенты после операции получали заместительную гормональную терапию в дозе, которые используются у пациентов с гормональной недостаточностью, находящихся в состоянии выраженного стресса: гидрокортизон 2,5 – 3 мг/кг/сут, L-тироксин 2-2,5 мкг/кг/сут. Данные представлены в виде медианы с указанием 25 и 75 перцентиля. При анализе данных использовались тест Манна-Уитни и отношение рисков. Различия считались достоверными при p<0,05, а риск считался достоверным, если нижняя граница доверительного интервала превышала единицу. Статистический анализ проводился с помощью программы Statistica 7.0.
Результаты исследования и их обсуждение
Согласно критериям включения в исследование вошло 83 пациента. 7 больных было исключено из анализа в соответствии с вышеуказанными критериями: 2 пациента с эпидуральной гематомой, 3 пациента с формированием атонической комы в течение 48 часов, 1 пациент с острым инфарктом миокарда и 1 – с ТЭЛА. Таким образом, было проанализировано 76 пациентов с осложненным течением раннего послеоперационного периода в возрасте от 19 до 77 лет (медиана 49 лет).
Женщин было 43 (56,6%), мужчин – 33 (43,4%). У 46 пациентов была аденома гипофиза, у 17 – краниофарингиома, в 8 наблюдениях – менингиома ХСО, и по одному наблюдению были представлены пациенты с глиомой и эпендимомой III желудочка, гемангиоперицитомой, эпидермоидной кистой и метастазом рака в ХСО.
У всех 76 пациентов (100%) выявлялись ИС и диснатриемия, развивающиеся, соответственно, на первые и вторые сутки после операции (Таблица №2).

С учетом анатомии и физиологии ДС это является логичным. Поскольку вазопрессин синтезируется в паравентрикулярном и супраоптическом ядре, депонируется в нейрогипофизе, а транспортируется туда по ножке гипофиза, то существует высокая вероятность периоперационного повреждения какой-либо одной или нескольких из этих анатомических структур. Это незамедлительно приводит к дизнатриемии. ИС также легко объяснить. Таламус, занимающий 4/5 ДС, вычленяет важную информацию, поступающую от всех сенсорных анализаторов, и передает только ее коре мозга. При повреждении этого ограничивающего механизма к коре поступает огромное количество ненужной информации, которую она не способна проанализировать, происходит очевидная перегрузка, приводящая к изменению сознания [9]. Эпиталамус синтезирует мелатонин, который затем депонируется в нейрогипофизе. Мелатонин имеет первостепенное значение для адекватного функционирования циркадного ритма сон-бодрствование. При повреждении эпиталамуса, ножки гипофиза или гипофиза развиваются нарушения сна, которые приводят к изменению сознания [10]. Кроме этого, различные ДС связаны со стволовыми структурами, лимбической системой, корой мозга. Морфологическое повреждение этих связей также может стать причиной ИС [11].
Дисфункция дыхательной, сердечно-сосудистой системы и водно-электролитные нарушения развивались на вторые сутки после операции, а парез желудочно-кишечного тракта – на третьи. Наиболее частыми СОД были дисфункция сердечно-сосудистой системы, кишечная дисфункция и дисфункция дыхательной системы. Дисфункция сердечно-сосудистой и дыхательной систем развивались на вторые сутки, соответственно, у 52 (68%) и 50 (66%) пациентов. Кишечная недостаточность развилась на третьи сутки у 51 (67%) пациента. Сердечно-сосудистая, дыхательная система и желудочно-кишечный тракт являются теми структурами, на которые ДС оказывают выраженное и непосредственное влияние. Исходя из этого, частое развитие этих СОД у пациентов с осложненным течением послеоперационного периода является логичным. Гораздо реже и позже развивалась тромбоцитопения – у 21 (28%) пациента с 4 суток после операции. Это объясняется тем, что уровень тромбоцитов регулируют другие механизмы. Почечная и печеночная дисфункция развивалась в ранние сроки после операции, но выявлялись очень редко – в трех (4%) и одном (1%) наблюдении, соответственно. ДС непосредственно не регулируют клубочковую фильтрацию, поэтому они не могут оказывать непосредственное влияние на клиренс креатинина [12]. При несахарном диабете почечная недостаточность формируется только при развитии декомпенсированной гиповолемии, которую легко избежать при проведении адекватной инфузионной и заместительной гормональной терапии препаратами вазопрессина. Кроме этого, почечная недостаточность может развиваться вследствие резистентной артериальной гипотензии, что возникает крайне редко у изучаемой группы пациентов [13]. ДС, вероятно, также лишены непосредственного регулирующего влияния на функцию печени, которая, однако, может страдать вследствие гипоперфузии на фоне резистентной артериальной гипотензии. Другой возможной причиной развития почечной и печеночной недостаточности может быть абдоминальный компартмент-синдром, развивающийся вследствие пареза желудочно-кишечного тракта [14]. Однако резистентная артериальная гипотензия и компартмент-синдром развиваются достаточно редко [13], что и отражается в частоте этих дисфункций у изучаемой категории пациентов.
Лихорадка развивалась у 18 (23,7%) пациентов, гипотермии не было выявлено ни в одном из наблюдений. Таким образом, дистермия, ранее описанная как характерный для повреждения ДС симптом, редко развивалась у наших пациентов.
При повреждении ДС нарушение функций надпочечников и щитовидной железы неизбежно. Клиническими проявлениями надпочечниковой и тиреоидной недостаточности являются артериальная гипотензия, бради- или тахикардия, гипотермия или лихорадка, парез желудочно-кишечного тракта, повышенная проницаемость мембран, приводящая к полисерозиту и интерстициальному отеку [2,15]. В соответствии с принятыми протоколами интенсивной терапии все пациенты, вошедшие в исследование, получали глюкокортикостероидные и тиреоидные гормоны в дозах, полностью замещающих их продукцию надпочечниками и щитовидной железой в условиях выраженного стресса. Из этого следует, что мы могли исключить надпочечниковую и тиреоидную недостаточность из числа причин развития вышеперечисленных органных нарушений.
Очевидно, что при повреждении задней доли гипофиза или его стебля неизбежно появятся ВЭН [2]. При каком варианте повреждений ДС у пациента облигатно разовьется ИС и СОД до сих пор остается неизвестным. Проведенный анализ также не смог ответить на этот вопрос. Это означает, что по-прежнему отсутствуют точные предоперационные и интраоперационные предикторы развития ИС и СОД.
Следует подчеркнуть, что до операции все пациенты, вошедшие в исследование, были в компенсированном состоянии, и у них не отмечалось проявлений соматических органных дисфункций, а ВЭН были менее выраженными или вовсе отсутствовали. Таким образом, при описании структуры послеоперационного СДД следует учитывать развившиеся после операции диснатриемию, ИС и СОД. Для определения вариантов СДД пациенты были разделены на группы в зависимости от комбинации выявленных дисфункций. Получилось 6 групп (Таблица №3).
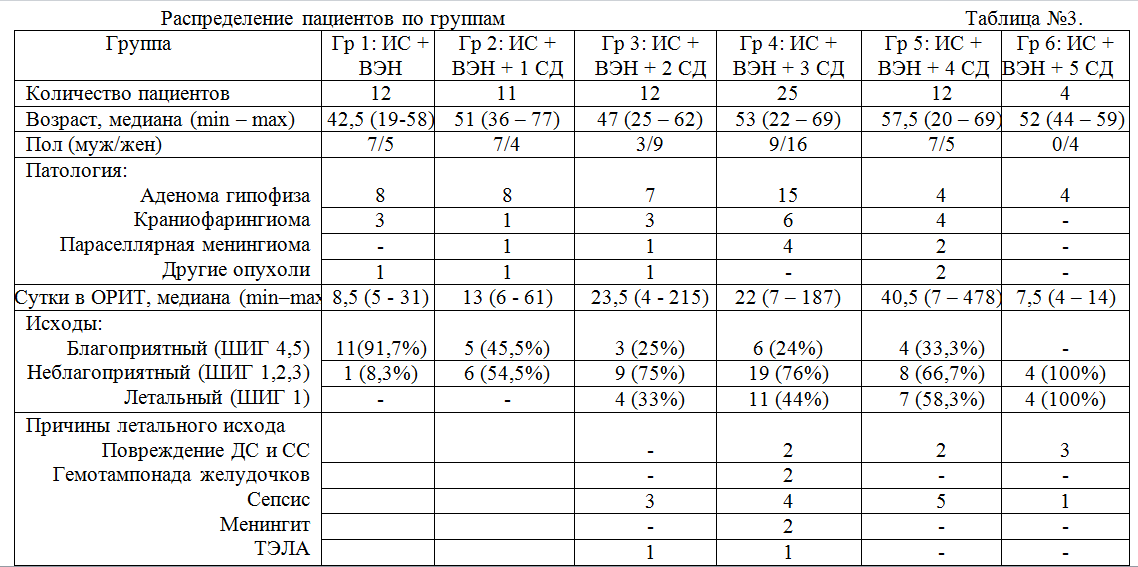 Примечание. Гр – группа; ИС – измененное сознание; ВЭН – водно-электролитные нарушения; СД – соматическая дисфункция; ОРИТ – отделение реанимации и интенсивной терапии; ШИГ – Шкала Исходов Глазго; ДС – диэнцефальные структуры; СС – стволовые структуры; ТЭЛА – тромбоэмболия легочной артерии.
Примечание. Гр – группа; ИС – измененное сознание; ВЭН – водно-электролитные нарушения; СД – соматическая дисфункция; ОРИТ – отделение реанимации и интенсивной терапии; ШИГ – Шкала Исходов Глазго; ДС – диэнцефальные структуры; СС – стволовые структуры; ТЭЛА – тромбоэмболия легочной артерии.
Группу 1 составили 12 пациентов. У них выявлялась изолированное сочетание ИС и ВЭН без СОД. Медиана возраста этих пациентов составила 42,5 лет, медиана продолжительности пребывания в ОРИТ - 8,5 суток. У 11 (91,7%) пациентов, по шкале исходов Глазго (ШИГ), был зафиксирован благоприятный исход (ШИГ=4), у одного пациента (8,3%) – неблагоприятный (ШИГ=3), летальных исходов не было.
Группу 2 составили 11 пациентов. Они имели одну СОД в дополнение к ИС и диснатриемии. Наиболее часто, у 6 (54,5%) пациентов, развивалась дисфункция сердечно-сосудистой системы. Парез кишечника развился у двух пациентов, и дыхательная недостаточность развилась в двух наблюдениях. В одном наблюдении выявлялась тромбоцитопения. Медиана возраста составила 51 год, а медиана длительности пребывания в ОРИТ – 13 суток. Благоприятный исход (ШИГ=4) был у 5 (45,5%) пациентов, неблагоприятный (ШИГ=3) был у 6 больных (54,5%).
Группу 3 составили 12 пациентов. У них выявлялось две СОД на фоне ИС и диснатриемии. Кишечная недостаточность развилась у 9 (75%) больных, дыхательная недостаточность - у 8 (66,7%) пациентов, сердечно-сосудистая - в 7 (58,3%) наблюдениях. Медиана возраста в этой группе составила 47 лет, а медиана продолжительности пребывания пациентов в ОРИТ – 23,5 суток. У 3 (25%) больных имел место благоприятный исход: ШИГ=4 в двух наблюдениях; ШИГ=5 в одном наблюдении. У 9 пациентов (75%) исход был неблагоприятный. Из них у 5 больных развилась грубая инвалидизация (ШИГ=3), а в 4 наблюдениях (33%) был зафиксирован летальный исход (ШИГ=1). Причиной смерти в 3 наблюдениях был сепсис, в одном – ТЭЛА.
Группу 4 составили 25 пациентов. У них выявлялись сразу три СОД в дополнение к ИС и диснатриемии. Дыхательная недостаточность развилась в 24 (96%) наблюдениях, сердечно-сосудистая недостаточность - у 23 (92%) пациентов, кишечная недостаточность - у 24 (96%). У 4 (16%) больных была отмечена тромбоцитопения. Медиана возраста в этой группе составила 53 года, медиана продолжительности пребывания в ОРИТ – 22 дня. Благоприятный исход отмечался у 6 (24%) пациентов: ШИГ=5 у двух пациентов, ШИГ=4 у четырех пациентов, неблагоприятный исход – у 19 больных (76%), из которых у 8 развивалась глубокая инвалидизация (ШИГ=3). Летальный исход имел место у 11 пациентов (44%). У 4 умерших пациентов причиной смерти был сепсис, у 2 – менингоэнцефалит, еще у 2 – гемотампонада желудочковой системы, дислокация и вклинение, 2 пациента скончались вследствие подтвержденного морфологического повреждения диэнцефальных структур, а 1 – вследствие ТЭЛА.
Группу 5 составили 12 пациентов. У них выявлялись одновременно четыре СОД с ИС и диснатриемией. У всех пациентов развивались дыхательная, сердечно-сосудистая, кишечная недостаточность и тромбоцитопения. Медиана возраста составила в этой группе 57,5 лет, медиана продолжительности пребывания в ОРИТ – 40,5 суток. Благоприятный исход (ШИГ=4) был зафиксирован у 4 (33,3%) пациентов этой группы. Неблагоприятный исход развился в 8 (66,7) наблюдениях. При этом только один из 8 пациентов с неблагоприятным исходом выжил (ШИГ=3). У остальных, 7 (58,3%) пациентов, имел место летальный исход (ШИГ=1). В 5 наблюдениях причиной смерти был сепсис, в 2 наблюдениях – повреждение диэнцефальных структур.
Группу 6 составили 4 пациента. У них развивалось одновременно 5 СОД с ИС и диснатриемией. У всех пациентов развивались дыхательная, сердечно-сосудистая, кишечная недостаточность и тромбоцитопения. У 3 пациентов выявлялась почечная дисфункция, а в одном наблюдении – печеночная. Медиана возраста в этой группе составила 52 года, медиана продолжительности пребывания в ОРИТ – 7,5 суток. В этой группе не было пациентов с благоприятным исходом, во всех наблюдениях наступил летальный исход. Причиной смерти у одного пациента был сепсис, у трех – морфологически подтвержденное повреждение диэнцефальных и структур.
Исходы пациентов первой группы с изолированным сочетанием ИС и диснатриемии были лучше, чем во всех остальных группах. Длительность их пребывания в ОРИТ была наименьшей. Различия между первой и второй группами не были достоверными (р=0,5). Однако, были получены достоверны различия по длительности пребывания пациентов в ОРИТ между первой и третьей, первой и четвертой группами (р=0.04 и р=0.01, соответственно). При анализе не учитывалась длительность пребывания в ОРИТ пациентов группы 5, поскольку это были наиболее тяжелые пациенты, у которых летальный исход наступил ранние сроки после операции. Благоприятные исходы в группе 1 развивались чаще, чем в других группах, а неблагоприятные – реже (Таблица №3). Риски развития неблагоприятного и летального исходов в группах 2 – 6, по сравнению с первой группой, приведены в таблице №4.
 Летальных исходов в группах 2 и 3 не было, а в группе 6 все пациенты имели летальный исход, поэтому в этих группах было невозможно высчитать риски.
Летальных исходов в группах 2 и 3 не было, а в группе 6 все пациенты имели летальный исход, поэтому в этих группах было невозможно высчитать риски.
Известно, что ряд пациентов с изолированной диснатриемией, изолированным ИС или даже сочетанием ИС и диснатриемии не требуют пребывания в ОРИТ в послеоперационном периоде [16]. У некоторых пациентов эти нарушения могут сохраняться в течение длительного времени после выписки их из стационара, а адекватно подобранная терапия позволяет вернуться пациентам к своей повседневной деятельности.
Очевидно, пациенты группы 1 имели более выраженные формы ИС и диснатриемии, чем больные с подобными нарушениями, но не требующие пребывание в ОРИТ. По сравнению с последними у пациентов группы 1 отличительной чертой являлась их нестабильность. Это проявлялось необходимостью изменения в течение суток проводимой интенсивной терапии. Однако тот факт, что одни и те же проявления могут быть, как у реанимационных пациентов, так и у тех, кто уже вернулся к своей повседневной деятельности, не позволяет выделить изолированное сочетание ИС и диснатриемию в одну из форм СДД.
В группе 2 количество неблагоприятных исходов существенно превысило количество благоприятных (Таблица №3). Это дает основание считать больных группы 2 пациентами первой стадии СДД. Следовательно, СДД – это синдром, включающий в себя измененное сознание, диснатриемию и, как минимум, одну соматическую органную дисфункцию. Исходы у пациентов каждой последующей группы были тяжелее, чем исходы пациентов предыдущей группы (Таблица №4). Риск развития неблагоприятного исхода по сравнению с первой группой был выше в каждой последующей группе: 13,2; 33; 34,8, соответственно (Таблица №4). Нижний предел доверительного интервала превышал единицу во всех группах, что свидетельствует о достоверности выявленного риска. Не понятно, почему риск развития неблагоприятного исхода в группе 5 по сравнению с группой 1 составил 22, тогда как в группе 3 и 4 – 33 и 34,8, соответственно. Однако в этой группе риск развития летального исхода по сравнению с первой группой был достоверно выше, причем для группы 4 риск развития летального исхода по сравнению с первой группой не достиг достоверного уровня (Таблица №4). Из этого следует, что СДД имеет 5 степеней тяжести. СДД 1 первой степени имеет ИС, диснатриемию и одну СОД. В каждой последующей степени добавляется по одной СОД.
СДД, по-сути, является вариантом синдрома полиорганной дисфункции (СПОД). Однако в отличие от СПОД, развивающегося на фоне синдрома системной воспалительной реакции, СДД имеет ряд принципиальных отличий. Во-первых, СДД обязательно включает в себя ИС и диснатриемию, которые не всегда развиваются при СПОД [17]. Во-вторых, для СДД нехарактерны почечная и печеночная дисфункция, типичные для СПОД [18]. В-третьих, существенным отличием являются сроки и очередность развития СОД. При СДД происходит раннее и фактически одновременное, в течение 1 – 3, суток развитие дыхательной, сердечно-сосудистой и кишечной дисфункции. Даже не характерная для СДД почечная дисфункция формировалась в течение полутора суток после операции. Для СПОД характерно более медленное и поэтапное появление СОД [19]. В-четвертых, тромбоцитопения имеет различную прогностическую значимость для СДД и СПОД. В нашем исследовании она выявлялась у 21 пациента, что значительно чаще, чем почечная или печеночная недостаточность, но существенно реже, чем сердечно-сосудистая, дыхательная или кишечная дисфункция. Это не дает оснований для суждения о том, является ли тромбоцитопения типичным или нетипичным феноменом для пациентов с СДД. В то время, как для СПОД тромбоцитопения типична [17,18]. Нами не было выявлено различий по частоте её встречаемости в различных группах. Другими словами, если появление любой другой органной дисфункции означает утяжеление состояния пациента и ухудшение его прогноза, то выявление тромбоцитопении мало что означало для исхода. Однако наиболее важным фактом является то, что, ни в одном из наших наблюдений тромбоцитопения не достигала уровня 50 тысяч в мкл, и почти всегда количество тромбоцитов превышало 100 тысяч в мкл. Это означало, что тромбоцитопения при СДД не требует коррекции в отличие от СПОД.
Выводы
У больных с нейрохирургической патологией ХСО синдром диэнцефальной дисфункции в послеоперационном периоде проявляется сочетанием измененного сознания, водно-электролитных нарушений в виде диснатриемии и, как минимум, одной соматической органной дисфункции.
Наличие у пациента измененного сознания и диснатриемии не достаточно для диагностики синдрома диэнцефальной дисфункции.
Тяжесть синдрома диэнцефальной дисфункции и исход определяются количеством развившихся соматических органных дисфункций.
Литература
- Бер М, Фротшер М. Топический диагноз в неврологии по Петеру Дуусу. Анатомия, физиология, клиника. Пер. с анг. под ред. З.А. Суслиной. 4-е изд. М: Практическая медицина, 2009. 478 стр.
- Endocrinology. DeGroot L.J., Jameson J.L. Elsevier Saunders, Philadelphia, 2006. p. 3336.
- Russell A. Diencephalic syndrome of emaciation in infancy and childhood.// Arch Dis Child, 1951. V.26 p274.
- Baguley I.J., Heriseanu R.E., Cameron I.D., et al. A critical review of the pathophysiology of dysautonomia following traumatic brain injury.// Neurocrit Care. 2008. V. 8 p. 293-300.
- Boeve B.F., Wijdicks E.F., Benarroch E.E. Paroxysmal sympathetic storms ("diencephalic seizures") after severe diffuse axonal head injury.// Mayo Clin. Proc. 1998. V. 73 p. 148-152.
- Clifton G.L., Robertson C.S., Kyper K. Cardiovascular response to severe head injury.// J Neurosurg. 1983. V. 59 p. 447-54.
- Vincent J.L., Moreno R., Takala J., et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. On behalf of the working group on sepsis-related problems of the European society of intensive care medicine.// Intensive Care Med. 1996. V. 22 p. 707-710.
- Попугаев К.А., Савин И.А., Горячев А.С. и др. Шкала оценки тяжести дыхательной недостаточности у нейрохирургических пациентов.// Анест. и реан., 2010. №4 c. 42-50.
- Stewart J.T., Quijije N., Sheyner I., Stover K.T. Delirium without focal signs related to a thalamic stroke.// J. Am. Geriatr. Soc. 2010. V. 58 p. 2433-2434.
- Figueroa-Ramos M.I., Arroyo-Novoa C.M., Lee K.A., et al. Sleep and delirium in ICU patients: a review of mechanisms and manifestations.// Intensive Care Med. 2009. V. 35 p. 781–795.
- Frontera J.A. Delirium and sedation in the ICU.// Neurocrit Care 2011. V. 14 p. 463-474.
- Legrand M., Payen D. Understanding urine output in critically ill patients.// Ann Intensive Care. 2011. V. 24 p.13.
- Popugaev K.A., Savin I.A., Goriachev A.S., Kadashev B.A. Hypothalamic injury as a cause of refractory hypotension after sellar region tumor surgery.// Neurocrit Care. 2008. V. 8 p. 366-373.
- Cheatham M.L.: Intra-abdominal hypertension and abdominal compartment syndrome.// New Horiz. 1999. V. 7 p. 96–115.
- Попугаев К.А., Савин И.А., Горячев А.С. и др. Вторичный абдоминальный компартмент синдром при осложненном течении послеоперационного периода у больных с опухолями хиазмально-селлярной локализации.// Анест. и реан., 2011. № 4 с. 37-42.
- Аденомы гипофиза: клиника, диагностика, лечение/ Под ред. Б.А. Кадашева. М.-Тверь: ООО «Издательство Триада», 2007. 368 с.
- Knaus W.A. and Wagner D.P. Multiple systems organ failure: epidemiology and prognosis.// Crit. Care Clin. 1989. V. 5 p. 221–232.
- Cerra F.B. Multiple organ failure syndrome./ In: Bihari DS, Cerra FB (eds). New Horizons. Multiple Organ Failure. Fullerton, CA: Society of Critical Care Medicine. 1989. p 1–24.
- Murray M.J., Coursin D.B. Multiple Organ Dysfunction Syndrome.// Yale J. Biol. Med. 1993. V. 66 p.501-510.






