Введение.
Изменение положения головного конца у пострадавших с ЧМТ является рутинным и простым методом коррекции ВЧД. В практике нейроинтенсивной терапии используют положения от 0 до 60 градусов, так как нет единого мнения, какое же именно положение наиболее эффективно снижает ВЧД и не компрометирует церебральный кровоток. Снижение АД на 20-30 мм рт.ст. при возвышенном положении головного конца было описано в физиологических условиях [1,2,3,4]. При церебральной патологии манипуляции с головным концом кровати могут приводить к церебральной ишемии, вследствие снижения АД, ЦПД и мозгового кровотока [5,6,7]. Очевидно, что проблема выбора положения головного конца при остром церебральном повреждении остается нерешенной.
В последнее время интерес практикующих врачей обращен к новому параметру динамической характеристики ВЧД - систоло-диастолической амплитуде колебаний ВЧД (амплитуда ВЧД) [8,9]. Данный параметр может нести полезную информацию, так как характеризует состояние пространственных резервов в полости черепа и косвенно отражает состояние тонуса церебральных сосудов [10]. Считается, что повышение амплитуды ВЧД, свидетельствует о снижении резервов пространственной компенсации и снижении тонуса церебральных сосудов [10,21,22]. Есть даже работы, в которых данный параметр обсуждается как независимый показатель исхода заболевания [11] и ориентир для определения оптимального значения ЦПД [12]. В своей работе мы оценили данный параметр как ориентир для выбора оптимального ЦПД при приподнимании головного конца.
Материалы и методы.
Обследовано 34 пациента, из них 14 лиц женского пола, с тяжелой ЧМТ. Тяжесть состояния по ШКГ соответствовала 5,6 +/- 1,2 балла. Средний возраст - 35 +/- 8,2 лет. Характер травмы среди пострадавших был следующим: у 21 (63%) пациента ЧМТ была с изолированной, у 13 (37%) сочетанной, у 12 (35%) открытой.
При поступлении в Институт Нейрохирургии и в динамике всем пострадавшим выполнялась компьютерная томография (КТ) головного мозга. По данным КТ у 22 (64%) пациентов было выявлено диффузное аксональное повреждение (ДАП) и очаговые ушибы 2-3 вида, у 12 (36%) были диагностированы внутричерепные гематомы, по поводу которых они были оперированы в первые сутки после травмы. Базовые лечебные мероприятия осуществляли в соответствии с международными рекомендациями [17].
Параметры ВЧД, АД, ЦПД регистрировались прикроватными монитороми Philips MP 40 и MP 60. Данные собирались через аналоговый выход на персональный компьютер и анализировались с помощью программы ICM Plus, UK. Состояние ауторегуляции мозговых сосудов оценивалось по коэффициенту Prx (pressure reactivity index) [13,14].
Критерии включения: пациенты с ЧМТ в коматозном состоянии, на ВИВЛ, при наличии инвазивного мониторинга АД, ВЧД и сохранной ауторегуляции, т.е. при Prx <0. Последнее условие было важным для однородности оцениваемой группы и возможности оценить феномен вазодилатации-вазоконстрикции в ответ на изменение ЦПД. Важным условием было отсутствие у пациентов ВЧД выше 25 мм рт.ст. на момент исследования.
При проведении теста с изменением положения головного конца кровати было выполнено 5 последовательных шагов, каждый длительностью по 5 минут в положениях 0 - 30 - 60 - 30 - 0 градусов. После стабилизации состояния в каждой точке в течении 5 минут, проводилась регистрация параметров среднего ВЧД, амплитуды ВЧД, среднего АД, ЦПД, ЕtСО2. Амплитуда ВЧД измерялась как разница между систолическим и диастолическим значениями ВЧД. Для измерения инвазивного АД проводилась катетеризация лучевой артерии. Датчик инвазивного АД всегда располагался на уровне наружного слухового прохода с целью корректного измерения ЦПД [15,16].
Измерение ВЧД проводилось паренхиматозным датчиком (Codman Microsensor Johnson & Johnson, Rayhman, МA, США), который имплантировался в точке Кохера на глубину 2-2,5 см в вещество головного мозга: при очаговом поражении со стороны большего повреждения или со стороны эвакуируемой гематомы, при диффузном повреждении в недоминатном полушарии головного мозга. В ходе исследования мы исключали колебания газового состава крови, все пациенты находились в в условиях миоплегии, ЕtСО2 в ходе исследования не изменялся. Перед исследованием больным проводилась дополнительная седация диазепамом 10 мг в/в и миорелаксация ардуаном 4 мг в/в.
Для статистической обработки данных использовалась программа Statistica 6.0 (StatSoft). Для анализа использовались параметрические и непараметрические методы статистики, множественный регрессионный анализ. Данные представлены в виде M+/-SD.
Результаты исследования и их обсуждение. При последовательном выполнении теста с изменением положения головного конца (0-30-60-30-0 градусов) происходили изменения среднего ВЧД (Табл. № 1 и Рис. 1).

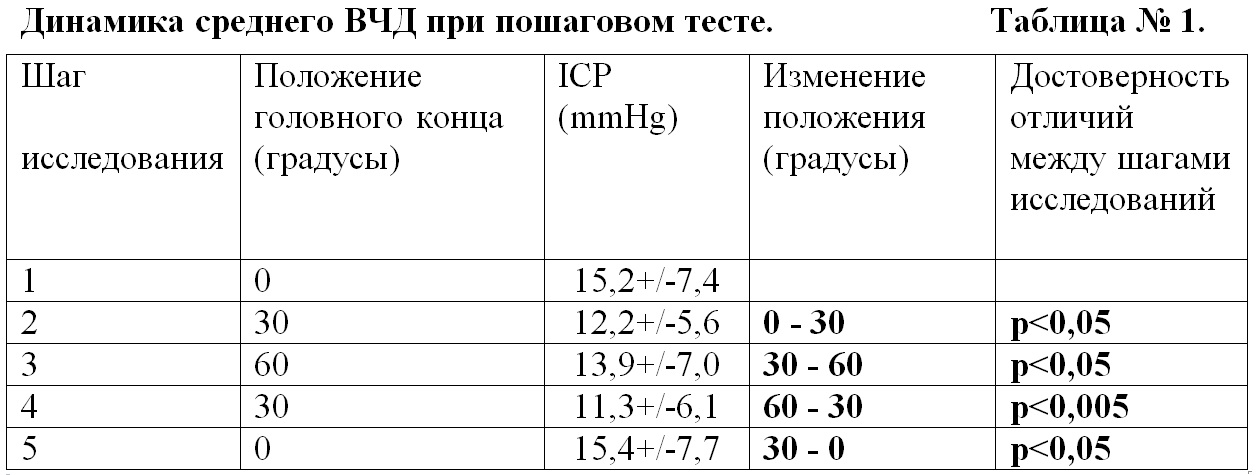
Минимальное значение среднего ВЧД было зафиксировано в положении 30 градусов (шаг 2 и 4), которое достоверно отличалось от положения 0 и 60 градусов ( p<0,05). ВЧД в положениях 0 и 60 градусов (шаг 1 и 3) достоверно не отличались. При положении 60 градусов регистрировалось достоверное повышение ВЧД по сравнению с положением в 30 градусов.
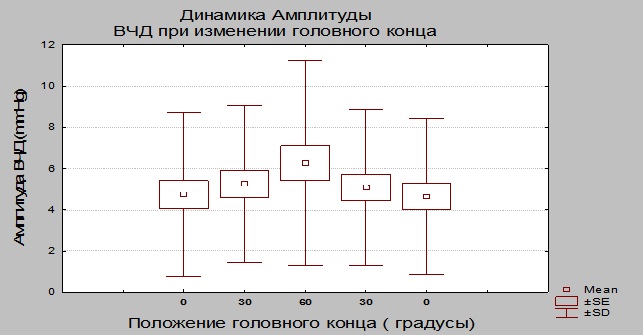
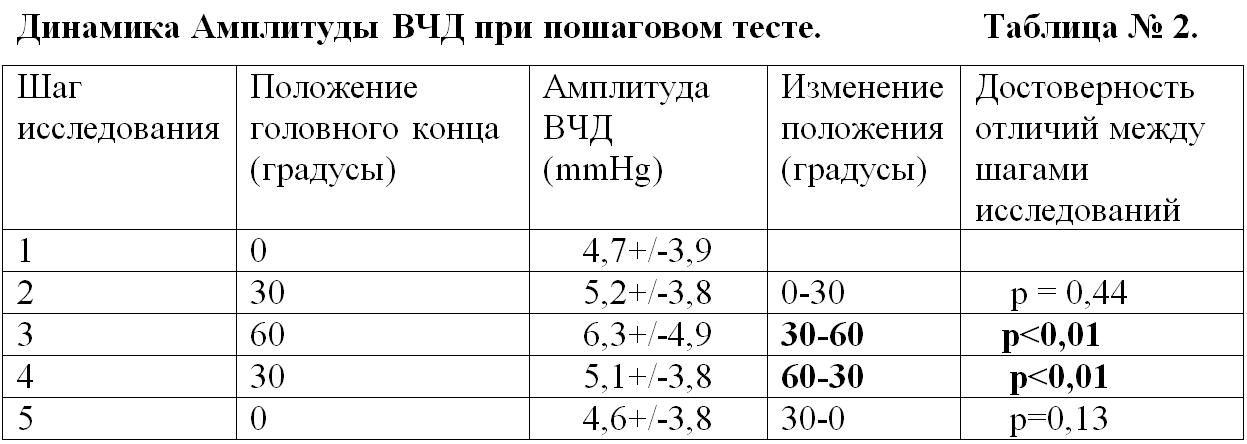
Динамика амплитуды ВЧД. При последовательном выполнении пошагового теста регистрировали нарастание амплитуды ВЧД. Максимальное значение амплитуды ВЧД наблюдали в положении 60 градусов, которое достоверно отличалось от значений амплитуды при положении 30 градусов. При переходе от 0 до 30 и обратно, значение амплитуды ВЧД достоверно не изменялось (Табл. № 2 и Рис. 2).
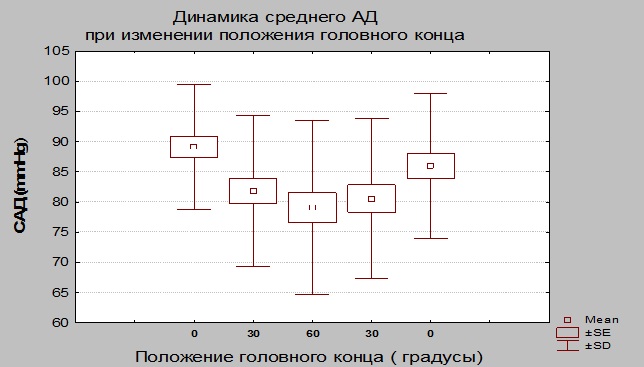
Динамика среднего АД. При придании возвышенного положения от 0 до 30 и 60 градусов происходило снижение САД. При опускании головного конца САД постепенно повышалось, достигая максимальных значений в 0 положении головного конца. Достоверные отличия регистрировались при переходе от 30 к 60 и от 30 к 0 градусов (Табл. № 3 и Рис. 3).
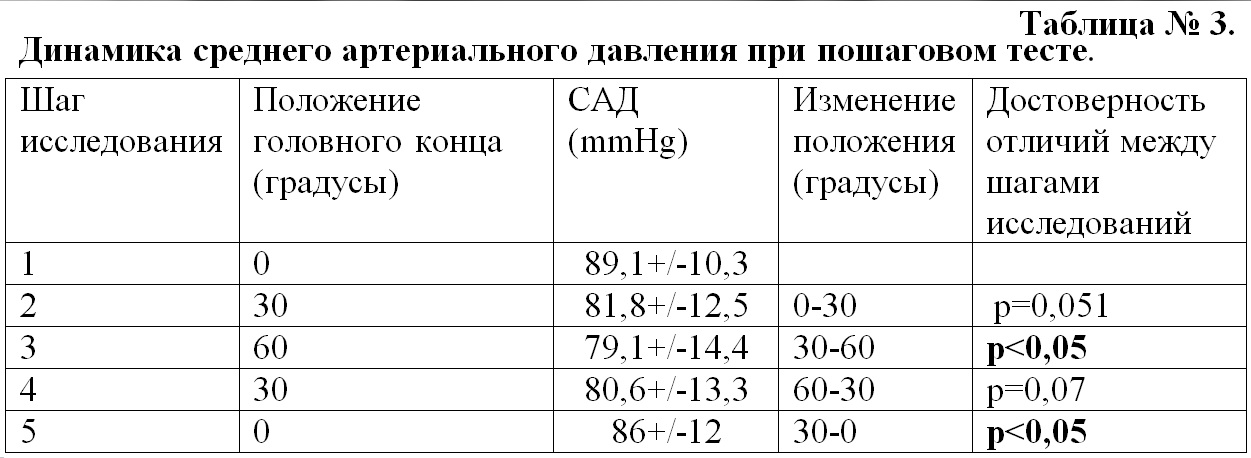
Динамика ЦПД. При выполнении пошагового теста мы регистрировали снижение ЦПД при переходе от 0 до 60 градусов и повышение ЦПД при опускании головного конца от 60 до 0 градусов. Достоверное изменение ЦПД регистрировалось только при переходе от 30 до 60 и от 60 до 30 градусов (p<0,01) (Табл. № 4 и Рис. 4)
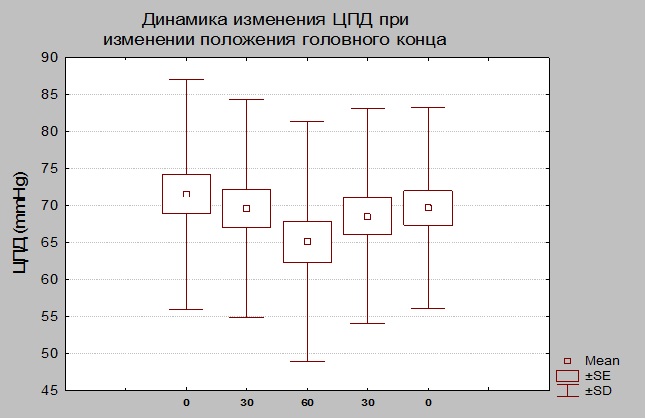
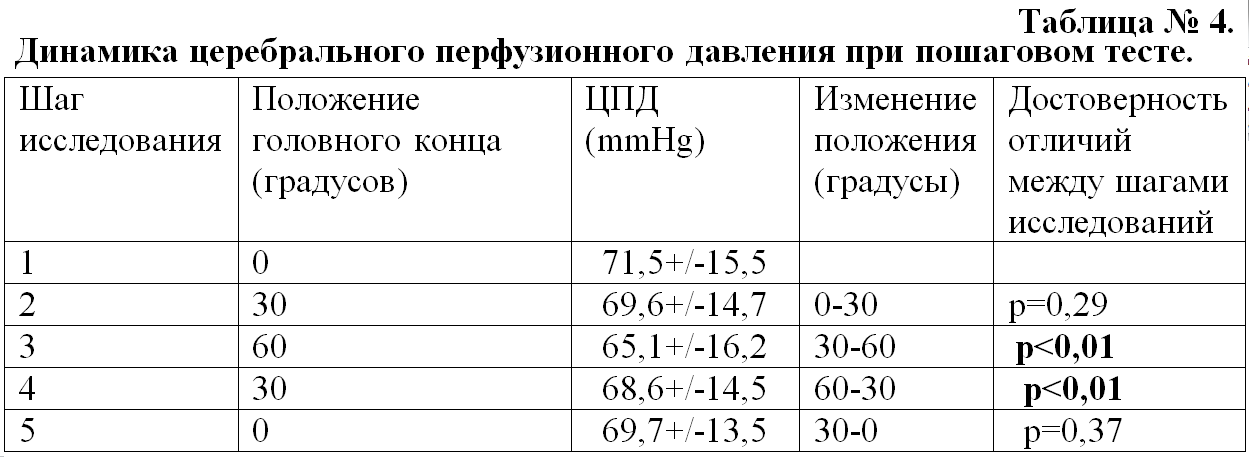
Как видно из представленных таблиц и графиков, динамика изменения ЦПД и амплитуды ВЧД имеет обратную зависимость. При проведении корреляционного анализа (Рис. 5) между регистрируемыми параметрами была установлена обратная корреляционная зависимость r=-0,5441, p=0,0005.
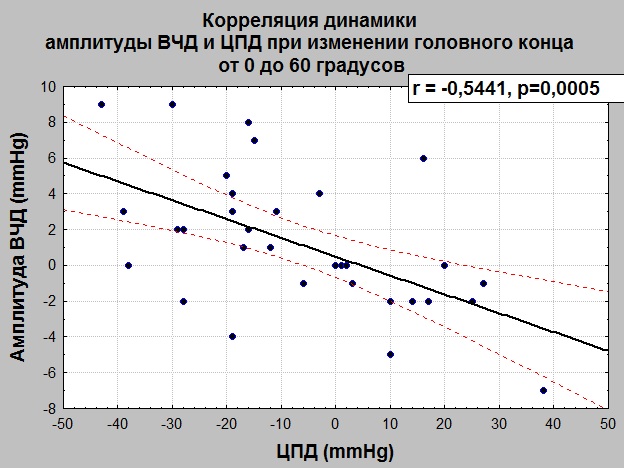
Достоверная обратная связь и высокая степень корреляции дает возможность использовать параметр амплитуды ВЧД, как ориентир для подбора ЦПД. Если со снижением ЦПД происходит повышение амплитуды ВЧД более 5 мм рт.ст., то это свидетельствует снижении пространственных резервов, вазодилатации артериол, увеличении кровенаполнения мозга.
Четких рекомендаций относительно положения головного конца кровати для пострадавших с ЧМТ не существует. Данная терапевтическая опция не рассмотрена в международных рекомендациях по ведению тяжелой ЧМТ [17]. В практике интенсивной терапии принято считать, что для большинства пациентов с церебральной патологией, независимо от этиологического фактора, предпочтительнее положение 15-30 градусов. Ранние работы, проведенные на пациентах с различной патологией, подтверждали эффективное снижение ВЧД при различных положениях головного конца в интервале от 15 до 60 градусов [5,6,18]. Это положение оправдано с физиологической точки зрения, так как даже незначительное приподнимание головного конца улучшает венозный и ликворный отток из полости черепа и приводит к снижению ВЧД [18,19].
В нашем наблюдении, при положении головного конца кровати в 30 градусов, происходило достоверное снижение среднего ВЧД, которое при дальнейшем поднимании головного конца до 60 градусов сменялось повышением среднего ВЧД. Очевидно, что первично срабатывал механизм улучшения ликворного и венозного оттока – улучшались условия пространственной компенсации в полости черепа. Однако при патологических состояниях, сопровождающихся отеком головного мозга механизмы пространственной компенсации могут быть снижены, поэтому эффективность манипуляции с приподниманием головного конца может варьировать.
Оценка пространственной компенсации поврежденного мозга возможна по данным компьютерной томографии: состояние субарахноидального пространства, выраженность борозд и извилин, состояние желудочковой системы, охватывающей цистерны. Однако более точным методом является динамическая оценка амплитуды ВЧД[10]. Современный компьютерный анализ и программное обеспечение позволяет проводить непрерывный анализ состояния внутричерепных взаимоотношений благодаря мониторингу среднего ВЧД, амплитуды ВЧД и множества производных расчетных коэффициентов [13,20,21,22].
В ранних клинических работах и экспериментальных исследованиях было отмечено, что между параметром среднего значения ВЧД и амплитудой ВЧД существовала строгая линейная корреляционная зависимость. Причем, при развитии выраженой внутричерепной гипертензии свыше 40-50 мм рт.ст. данная линейная зависимость нарушается [23,24]. Работы проведенные Eide et al. показали, что утрата линейной зависимости между двумя параметрами ВЧД (декорреляция) может развиваться даже при нормальных значениях среднего ВЧД, т.е. повышение амплитуды может произойти без увеличения среднего значения ВЧД. Такой феномен «декорреляции», по мнению авторов, свидетельствует о снижении комплайнса мозга и снижении пространственной компенсации внутричерепного пространства [8, 11].
В нашем исследовании декорреляция между параметрами ВЧД уже была зарегистрирована (Рис. 1 и 2) в положении 30 градусов. Происходило снижение среднего ВЧД, но увеличивалась амплитуда ВЧД. Вероятно, мы регистрировали снижение комплайнса мозгового вещества из-за истощения механизмов пространственной компенсации. Следует напомнить, что все пациенты в данном исследовании имели признаки травматического отека и нуждались в мониторинге ВЧД и, соответственно, на момент проведения исследования у большинства из них уже были запущены механизмы пространственной компенсации, о чем свидетельствует сужение ликворных пространств головного мозга по данным КТ. Интересно, что дальнейшее приподнимание головного конца до 60 градусов приводило к дальнейшему росту амплитуды ВЧД> 5мм рт.ст. и одновременному повышению среднего ВЧД. Синхронное повышение среднего ВЧД и амплитуды ВЧД регистрировалось на фоне дальнейшего снижения АД и ЦПД. По нашему мнению, данный механизм повышения параметров ВЧД (среднего и амплитуды) у пациентов с сохранным механизмом ауторегуляции, можно объяснить только запуском ауторегуляционных механизмов мозговых сосудов. В ответ на снижение церебрального перфузионного давления запускается каскад вазодилатации, что приводит к увеличению кровенаполнению головного мозга, а так как резервы пространственной компенсации уже использованы (начиная с положения в 30 градусов), то происходит повышение ВЧД. По мнению Rosner et al., возвышенное положение головного конца эффективно может снижать ВЧД только у 50% пациентов с нейрохирургической патологией [6]. Кроме того, даже в нормальных физиологических условиях при вертикализации тела могут происходить значительные колебания мозгового кровотока. Так сообщалось, что при приподнимании головного конца выше 20 градусов регистрировалось снижение мозгового кровотока на 14-21% [4,25,26]. Данные колебания кровотока могут быть компенсированы механизмом ауторегуляции мозговых сосудов, который обеспечивает постоянство мозгового кровотока за счет изменения просвета артериол [27]. При церебральной патологии, сопровождающейся утратой ауторегуляторных механизмов, снижение мозгового кровотока может приводить к формированию церебральной ишемии. Причем у таких пациентов может происходить пассивное снижение ВЧД вслед за снижением системного АД [28]. В таких случаях строгий контроль ЦПД может обеспечивать профилактику церебральной ишемии. Механизмы, обеспечивающие постоянство перфузионного давления при поднимании головного конца можно разделить на два основных. Первый, это как описывалось выше механизм ауторегуляции, обеспечивающий постоянство мозгового кровотока. Второй механизм направлен на обеспечение постоянного перфузионного давления. Его можно объяснить тем, что до определенного уровня вместе со снижением АД, происходит снижение ВЧД, в основном за счет улучшения венозного и ликворного оттока. Причем венозное давление во внутренней яремной вене (как и ВЧД) при вертикализации могут достичь отрицательных значений. Поэтому даже на фоне снижения АД обеспечивается постоянство артерио-венозного градиента в полости черепа, который является ведущим фактором, определяющим объемный мозговой кровоток [2, 3, 29].
В нашем исследовании снижение среднего ВЧД на уровне 30 градусов сменялось ростом значения ВЧД на уровне 60 градусов. При этом регистрировалась тенденция к повышению амплитуды ВЧД, которая развивалась на фоне снижения АД и ЦПД. Установлена достоверная обратная корреляционная зависимость между динамикой амплитуды ВЧД и ЦПД. Проведенный анализ позволяет использовать параметр амплитуды ВЧД, как ориентир для выявления синдрома гипоперфузии и декомпенсации пространственных резервов. По нашему мнению, рост амплитуды ВЧД может быть объяснен, как реализация каскада вазодилатации у пациентов с сохранной ауторегуляцией, в ответ на снижение ЦПД. Рост среднего ВЧД в положении 60 градусов на фоне снижения АД и ЦПД, косвенно подтверждает, что происходит увеличение кровенаполнения мозга за счет вазодилататорного механизма.
Выводы
Амплитуда ВЧД является простым и доступным методом оценки адекватности ЦПД при изменении положения головного конца кровати у пациентов с сохранными механизмами ауторегуляции мозгового кровотока. Утрата линейной зависимости между параметрами среднего ВЧД и амплитуды ВЧД при подъеме головного конца кровати указывает о декомпенсации пространственных резервных механизмов в полости черепа. Одновременное повышение среднего ВЧД и амплитуды ВЧД при подъеме головного конца кровати может указывать на гипоперфузию мозга и запуск каскада вазодилатации церебральных сосудов.
Литература
- Gauer O.H., Thron H.L. Postural changes in the circulation, in Hamilton WF (ed): Circulation. Handbook of Physiology. V. 3, 2nd ed. Bethesda. American Physiological Society. 1965. p. 2409–2439.
- Patterson J.L. Jr., Cannon J.L. Postural changes in the cerebral circulation studied by continuous oximetric and pressure-recording techniques.// J. Clin. Invest. 1951. V.30. p.664. (Abstract).
- Patterson J.L. Jr., Warren J.V. Mechanisms of adjustment in the cerebral circulation upon assumption of the upright position.// J. Clin. Invest. 1952. V.31. p.653. (Abstract).
- Scheinberg P., Stead E.A. Jr. The cerebral blood flow in male subjects as measured by the nitrous oxide technique. Normal values for blood flow, oxygen utilization, glucose utilization, and peripheral resistance, with observations on the effect of tilting and anxiety.// J. Clin. Invest. 1949. V.28. p.1163–1171.
- Durward Q.J., Amacher A.L., Del Maestro R.F., et al. Cerebral and cardiovascular responses to changes in head elevation in patients with intracranial hypertension.// J. Neurosurg. 1983. V.59. p.938–944.
- Rosner M.J., Coley I.B. Cerebral perfusion pressure, intracranial pressure, and head elevation.// J. Neurosurg. 1986. V.65. p.636–641.
- Yoshida A., Shima T., Okada Y., et al. Effects of postural changes on epidural pressure and cerebral perfusion pressure in patients with serious intracranial lesions.//In: Avezaat C.J.J., vanEijndhoven J.H.M., Maas A.I.R., et al. (eds): Intracranial Pressure VIII. Berlin: Springer-Verlag. 1993. p.433–436.
- Eide P.K., Rapopport B.I. Gormley W.B., et al. A dynamic nonlinear relationship between the static and pusatile components of intracranial pressure in patients with subarachnoidal hemorrhage.// J. Neurosurg. 2010. V.112. p.616-625.
- Gzosnyka M., Guazzo E., Whitehouse M., et al. Significance of intracranial pressure waveform analysis after head injury.// Acta Neurochir. (Wien). 1996. V.138. p.531-541.
- Averzaat G.J., van Eijndhoven J.H., Wyper D.J. Cerebrospinal fluid pulse pressure, intracranial volume-pressure relationships.// J. Neurol. Neurosurg. Psychiatry. 1979. V.42. p.687-700.
- Eide P.K., Bensten G., Sorteberg A. et al. A randomized and blinded single-center trail comparing the effect of intracranial pressure and pressure wave amplitude-guided intensive care management on early clinical state and 12-month outcome in patient with aneurismal subarachnoid hemorrhage.// Neurosurg. 2011. V.69. p.1105-1115.
- Mahfoud F., Beck J., Raabe A. Intracranial pressure pulse amplitude during changes in head elevation: a new parameter for determining optimum cerebral perfusion pressure?// Acta Neurochir. (Wien). 2010. V.152. p.443-450.
- Smielewski P., Czosnyka M., Zabolotny W., Kirkpatrick P., Richards H., Pickard J.D. A computing system for the clinical and experimental investigation of cerebrovascular reactivity.// Int. J. Clin. Monit. Comput. 1997. V.14. p.185-198.
- Czosnyka M., Smielewski P., Kirkpatrick P., Menon D.K., Pickard J.D. Monitoring of cerebral autoregulation in head-injured patients.// Stroke. 1996. V.27. p.1829-1834.
- Torbey M.T. Neurocritical Care: Cambridge University Press; 2010.
- Nates J.L., Niggemeyer L.E., Anderson M.B., Tuxen D.V. Cerebral perfusion pressure monitoring alert!// Critical Care Med. 1997. V.25. p.895–896.
- Brain Trauma Foundation. Guidelines for the management of severe traumatic brain injury.// J. Neurotrauma. 2007. V.24. Suppl 1. p.S59-64.
- Kenning J.A., Toutant S.M., Saunders R.L. Upright patient positioning in the management of intracranial hypertension.// Surg. Neurol. 1981. V.15. p.148-152.
- Magnaes B. Body position and cerebrospinal fluid pressure. Part 1: clinical studies on the effect of rapid postural changes.// J. Neurosurg. 1976. V.44. p.687–697.
- Eide P.K. A new method for processing of continuous intracranial pressure signals.// Med. Eng. Phys. 2006. V.28. p.579–587.
- Eide P.K., Sorteberg W. Association between intracranial compliance, intracranial pulse pressure amplitude and intracranial pressure in patients with intracranial bleeds.// Neurol. Res. 2007. V.29. p.798–802.
- Czosnyka M., Pickard J.D. Monitoring and interpretation of intracranial pressure.// J. Neurol. Neurosurg. Psychiatry. 2004. V.75. p.813–821.
- Avezaat C.J.J., van Eijndhoven J.H.M. The role of the pulsatile pressure variations in intracranial pressure monitoring.// Neurosurg. Rev. 1986. V. 9. p.113–120.
- Avezaat C.J.J., van Eijndhoven J.H.M., deJong D.A., Moolenaar W.C.J. A new method of monitoring intracranial volume/pressure relationship.// In: Beks J.W.F., Bosch D.A., Brock M. (eds). Intracranial Pressure. Berlin: Springer-Verlag. 1976. V.3 p.308–313.
- Tindall G.T., Craddock A., Greenfield J.C. Jr. Effects of the sitting position on blood flow in the internal carotid artery of man during general anesthesia.// J. Neurosurg. 1967. V.26. p.383–389.
- Shenkin H.A., Scheuerman W.G., Spitz E.G., et al. Effect of change of position upon the cerebral circulation of man.// J. Appl. Physiol. 1949. V. 2. p.317–326.
- Lindegaard K.F., Lundar T., Wiberg J., et al. Variations in middle cerebral artery blood flow investigated with noninvasive transcranial blood velocity measurements.// Stroke. 1987. V.18. p.1025–1030.
- Langfit T.W., Weinstein J.D., Kassell N.F. Cerebral vasomotor paralysis produced by intracranial hypertension.// Neurology. 1965. V.15. p.622-641.
- Moraine J-J., Berre J., Melot C. Is cerebral perfusion pressure a major determinant of cerebral blood flow during head elevation in comatose patient with severe intracranial lesion?// J. Neurosurg. 2000. V.92. p.606-614.






