Резюме
Нарушение питания у пациентов приводит к большому числу неблагоприятных последствий и может ухудшать результаты лечения. Оперативное вмешательство, является стрессом для организма, и приводит к запуску ряда патофизиологических механизмов изменяющих структуру метаболизма. Целью нашего исследования явилась оценка результатов проводимой стандартной подготовки, влияние плановой нейрохирургической операции, не сопровождающейся периоперационными осложнениями на состояние белкового обмена. В исследование было включено 24 пациента, подготовленных к плановому оперативному вмешательству. План обследования пациента включал: измерение антропометрических показателей - рост, масса тела, окружность плеча и толщина кожной складки над трицепсом; определение потерь белка, путем определения потерь азота с мочой; оценку степени белкового катаболизма; определение степени нарушений нутритивного статуса на основании анализа данных лабораторных параметров. В ходе проведенного исследования были выявлены значимое (p<0,05) снижение показателей общего белка, альбумина, трансферрина и абсолютного числа лимфоцитов в послеоперационном периоде. У всех пациентов развивался тяжелый белковый катаболизм. Стало понятно, что плановое неосложненное нейрохирургическое вмешательство в сочетании с принятой схемой предоперационной нутритивной терапии приводит к тяжелой степени белкового катаболизма у всех пациентов.
Введение
Нарушение питания (НП) пациентов с любой патологией обладает неблагоприятным эффектом практически на все функции организма, и ухудшает результаты лечения. [7]. НП у пациентов, находящихся в критическом состоянии, проявляются в виде синдрома гиперметаболизма-гиперкатаболизма. Также описано развитие синдрома гиперметаболизма-гиперкатаболизма, вследствие тяжелой травмы, сепсиса, ожогов и других патологических состояний [8]. Несвоевременное начало нутритивной поддержки у пациентов в критических состояниях приводит к усугублению НП, вызывая нарушения иммунного ответа и замедление восстановительных процессов [9]. Компенсация потерь энергии и белка после перенесенного критического состояния, даже при проведении сбалансированного лечебного питания, занимает длительный период времени, нередко превышающий продолжительность пребывания больного в отделении реанимации [9]. Любое оперативное вмешательство, в том числе и нейрохирургическое, это стресс для организма, на который он реагирует каскадом патофизиологических реакций, приводящих к различным изменениям метаболизма [5,6,8]. В мировой литературе приводится большое количество данных о нарушении питания и белкового обмена у больных общехирургического профиля [2,3,4], которые проявляются синдромом гиперметаболизма-гиперкатаболизма. В доступной медицинской литературе мы не нашли данных об изменениях белкового метаболизма в периоперационном периоде у пациентов с опухолями головного мозга, удаление которых не сопровождалось хирургическими и анестезиологическими осложнениями. Стандартная подготовка к плановой нейрохирургической операции в Институте нейрохирургии использует стол №15 в предоперационном периоде, что в среднем составляет 2514 ± 87 ккал/сут и 90 ± 3,2 г/сут белка. Непосредственно перед нейрохирургическим вмешательством, прием пищи исключается в течение 16 часов. Еще в течение 8 - 20 часов после операции прием пищи также отсутствует. Целью нашего исследования явилась оценка результатов проводимой стандартной подготовки, влияние плановой нейрохирургической операции, не сопровождающейся периоперационными осложнениями на состояние белкового обмена.
Материал и методы исследования
В исследование было включено 24 пациента, подготовленных к плановому оперативному вмешательству в возрасте от 20 до 75 лет, 8 (33,3%) мужчин и 16 (66,7%) женщин, без признаков исходного нарушения нутритивного статуса, индекс массы тела в среднем составил 27,1± 5,7 (норма 20 – 25,9) в возрасте 25 до 72 лет. Средний возраст пациентов составил 47,7 ± 11 лет. Всем пациентам выполнялось плановое нейрохирургическое вмешательство, не сопровождавшееся интраперационными осложнениями, кровопотеря в ходе оперативного вмешательства у которых составляла примерно около 500 мл.
Из исследования исключались пациенты, с проявлениями выраженной соматической патологии, повторно подвергшихся оперативному вмешательству и с осложнившимся послеоперационным периодом, требующим пребывания в отделении реанимации и интенсивной терапии более 48 часов.
План обследования пациента включал: I. Измерение антропометрических показателей. Рост, масса тела, окружность плеча и толщина кожной складки над трицепсом II. Определение потерь белка, путем определения потерь азота с мочой. III. Оценку степени белкового катаболизма. Легкая степень катаболизма характиризуется потерей до 6 г азота в стуки, средняя до 12 г азота в сутки, тяжелая степень катаболизма характеризуется потерей азота более 12 г, что соответствует потерям более 75 г белка в сутки. [1] IV. Определение степени нарушений нутритивного статуса на основании анализа данных лабораторных параметров: концентрации общего белка, альбумина, трансферрина в сыворотке крови, абсолютного числа лейкоцитов в периферической крови, азотистого баланса, разницы между поступившим в организм и выделенным с мочой азотом, и креатин-ростового индекса [3]. Для того чтобы определить реакцию организма на нарушения питания оценивались следующие показатели: Потери азота с мочой. Методика представляет собой сбор суточной мочи у пациента и определение общего количества мочевины и креатинина в суточной моче.
Потери азота(г/сут)= Мочевина мочи (ммоль/л) Х объем мочи (л) Х 28/1000 [1]
Также у всех обследованных пациентов к потерям добавлялось еще 6 г/сут на не мочевые потери белка [1]. Абсолютное число лимфоцитов – уровень которых, отражает функциональное состояние иммунной системы. Методика представляет собой пересчет процентного содержания лимфоцитов в крови в абсолютные значения [1]. Креатинин-ростовой индекс (КРИ) – показатель, характеризующий соматический запас белка. Рассчитывался путем вычисления по формуле, используя показатели идеальной и фактической экскреции креатинина с мочой [1,2]
КРИ=ФЭК (мг/сут)/ИЭК (мг/сут) Х 100) [1,2]
Определение энергетических затрат. Использовались две методики расчета показателей основного обмена: по уравнению Харриса-Бенедикта и определение уровня основного обмена исходя из потерь азота с мочой. Для определения энергопотребностей пациента по Харрису-Бенедикту использовалось стандартное уравнение для мужчин и для женщин с умножением на соответствующие поправочные коэффициенты (таблица №1).
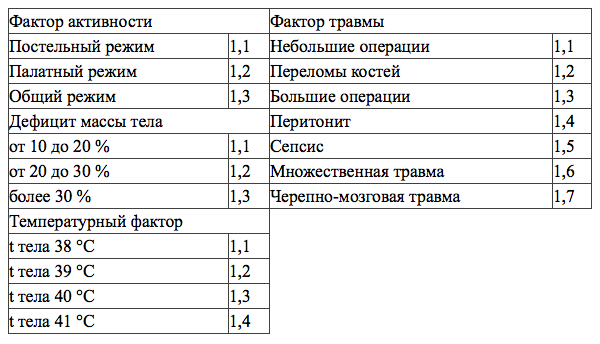
Фактор травмы нами был определен такой же, как для небольших операций, учитывая что оперативное вмешательство было плановым и не сопровождалось интраоперационными осложнениями. Основной обмен для мужчин =66,47+(13,7 Х вес(кг))+(5 Х рост(см))-(6,8 Х возраст (годы)) Х фактор активности Х фактор повреждения Х температурный фактор Х дефицит массы тела [1] Основной обмен для женщин= 665,31+(9,6 Х вес(кг))+(1,85 Х рост(см))-(4,7 Х возраст (годы)) Х фактор активности Х фактор повреждения Х температурный фактор Х дефицит массы тела [1]
Для определения энергопотребностей пациента, исходя из степени потери азота, мы использовали уравнение, учитывая, что каждый грамм азота должен быть обеспечен 150 килокалориями [1] Основной обмен=150 Х потери азота( г/сут) [1]
Обследование, согласно принятой программе, было выполнено во всех наблюдениях двухкратно: за 24 часа до проведения оперативного вмешательства и в раннем послеоперационном периоде, через 24 часа после нейрохирургического вмешательства. По характеру локализации патологического процесса в исследовании включались пациенты с доброкачественными опухолями задней черепной ямки 41,7% (10 наблюдений) и больших полушарий 58,3% (14 наблюдений).
Результаты и их обсуждение
В дооперационном периоде состояние исследуемых пациентов было компенсированным и стабильным. У всех пациентов был сохранен аппетит, показатели белкового питания (общий белок, альбумин и трансферрин) были в пределах нормы. Только у трети пациентов наблюдался катаболизм легкой степени выраженности вследствие самостоятельной отмены ежевечернего приема пищи. В результате проведенного обследования были получены следующие данные. Средние потери азота у пациентов до операции составили 14,1±3,4 г/сут, однако, только у 33,3% был выявлен катаболизм легкой степени тяжести (до 6 г/сут). После операции средние потери азота составили 13,9 ± 3,4 г/сут. Однако учитывая отсутствие питания у пациентов в течение 16 часов до и (8 – 12) часов после оперативного вмешательства, эти показатели полностью отражали степень белкового катаболизма, тогда как до операции потери были практически полностью покрыты поступившим в организм азотом. Полученные данные свидетельствовали о развитии выраженного белкового катаболизма у всех пациентов перенесших плановое неосложненное нейрохирургическое вмешательство.
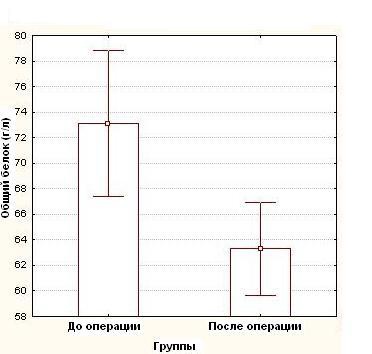
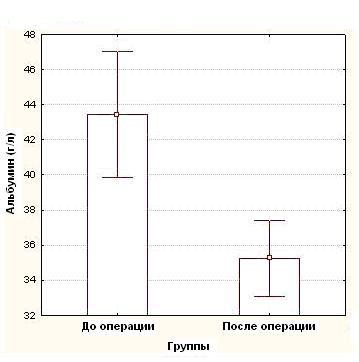
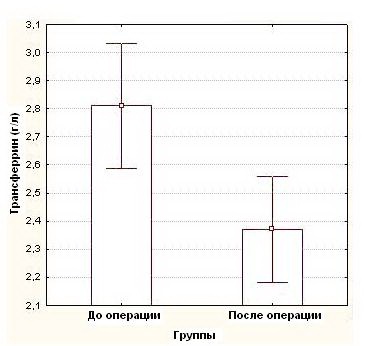
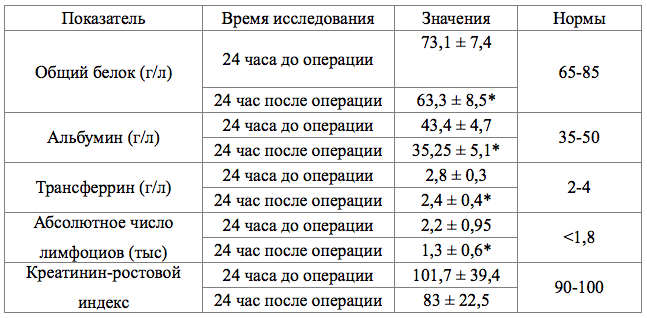
Средние показатели концентрации белков в сыворотке крови, составили до операции: общий белок – 73,1 ± 7,4 г/л, альбумин 43,4 ± 4,7 г/л и трансферрин – 2,8 ± 0,3 г/л, тогда как после операции эти показатели были достоверно (p<0,05) ниже и составили в среднем: общий белок - 63,3 ± 8,5 г/л (рисунок 1), альбумин - 35,25 ± 5,1 г/л (рисунок 2), трансферрина - 2,4 ± 0,4г/л (рисунок 3), (таблица №2)
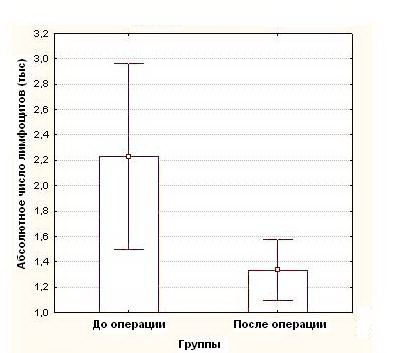
Показатель абсолютного числа лимфоцитов достоверно снижался составив до операции 2,2 ± 0,95тыс, а после операции - 1,3 ± 0,6тыс (р<0,05) (рисунок 4). (таблица №2)
Показатели уровней основного обмена до и после операции, достоверно не различались (таблица №3). При оценке энергопотребностей по уравнению Харриса-Бенедикта и по потерям белка была выявлена значимая корреляция (r=0.35 при р<0,05) между двумя методами определения уровня основного обмена.
В результате исследования было установлено, что сочетание принятой в Институте схемы предоперационной нутритивной подготовки и неосложненного нейрохирургического вмешательства приводит к выраженному белковому катаболизму у пациентов.

Мы не можем достоверно заключить, что является ведущей причиной возникающих метаболических нарушений, белкового катаболизма и следующей за этим белковой недостаточности: 36 часовой период голодания наших пациентов, сам факт неосложненной нейрохирургической операции или сочетание данных факторов.
Схема периоперационного питания пациентов в нашей клинике отличается от рекомендаций разработанных и принятых для плановых общехирургических вмешательств. По данным руководства европейского общества энтерального и парентерального питания, нутритивную поддержку необходимо начинать с первых часов после операции и в течение первых 24 часов переходить на нормальное питание [10]. Специализированных рекомендаций для нейрохирургических пациентов перенесших плановое оперативное вмешательство нами найдено не было.
Для адекватной оценки степени белкового катаболизма и его предупреждения в раннем послеоперационном периоде не обязательно определять уровень потери азота с мочой у каждого пациента, по нашему мнению, достаточно корректировать нутритивную поддержку на основании расчета энергопотребностей по уравнению Харриса-Бенедикта.
Результаты исследования обосновывают необходимость коррекции схемы питания в периоперационном периоде принятой в Институте. Как первый этап должна быть разработана схема раннего кормления пациентов после оперативного вмешательства. По-видимому начинать кормление пациентов после планового неосложненного нейрохирургического вмешательства надо уже через несколько часов после экстубации, при условии наличия перистальтики и отсутствия тошноты и рвоты, специализированными сбалансированными смесями для перорального применения (методом сипинга). Также следует корректировать нрутритивную поддержку пациентов с учетом их трофического статуса до оперативного вмешательства и по возможности сокращать периоды периооперационного голодания. В дальнейшем мы планируем оценить влияние адекватной периоперационной нутритивной поддержки на белковую недостаточность, влияние осложнений оперативного вмешательства на степень белкового катаболизма и проанализировать зависимость топографии расположения опухолевого процесса на возникновении и структуру нутритивной недостаточности.
Выводы
Плановое нейрохирургическое вмешательство по поводу удаления доброкачественных опухолей головного мозга в сочетании с приятой схемой нутритивной подготовки пациента приводит к белковому катаболизму. У всех анализируемых пациентов в послеоперационном периоде развивается тяжелая степень белкового катаболизма. Выявлена значимая корреляция между двумя методами определения энергопотребностей пациента, по формуле Харриса-Бенедикта и исходя из потерь азота с мочой.
Литература
- Бутров А.В., Попова Т.С., Свиридов С.В., Сепушкин В.Д., Мамонтова О.А., Звягин А.А., Зингеренко В.Б., Шестопалов А.Е., Шулутко Е.М., Щербакова Г.Н., Яцков К.В., Парентеральное питание в интенсивной терапии и хирургии: Методические рекомендации, Москва, 2006
- Руководство по клиническому питанию, Под редакцией Луфта В.М., Багненко С.Ф., Щербука Ю.А., Санкт-Петербургский НИИ скорой помощи им. И.И. Джанелидзе, Санкт-Петербург, 2010, 74, 83-102
- Руководство по парентеральному и энтеральному питанию, Под редакцией Хорошилова И.Е., Нормед-издат, Санкт-Петербург, 2000, 45, 63-73.
- Buzby G.P., Mullen J.L., Mattews D.C., Hobbs C.L., Rosato E.F., Prognostic nutritional index in gastrointestinal surgery, Am.J.Surg. 1980., 139, №1, 160-166
- Grimble R., Basics in clinical nutrition: Main cytokines and their effect during injury and sepsis e-SPEN, the European e-Journal of Clinical Nutrition and Metabolism (2008) 3, e289ee292
- Hammarqvist F., Wernerman J., Allison S., Basics in clinical nutrition: Injury and sepsis – The neuroendocrine response e-SPEN, the European e-Journal of Clinical Nutrition and Metabolism 4 (2009) e4–e6
- Meier R., Stratton R., Basic concepts in nutrition: Epidemiology of malnutrition be-SPEN, the European e-Journal of Clinical Nutrition and Metabolism (2008) , e167ee170
- Sobotka L., Soeters P., Basics in clinical nutrition: Metabolic response to injury and sepsis e-SPEN, the European e-Journal of Clinical Nutrition and Metabolism 4 (2009) e1–e3
- Villet S., Chiolero R., Bollmann M. Revelly J-P., Cayeux M-C., Delarue J., Berger M., Negative impact of hypocaloric feeding and energy balance on clinical outcome in ICU patients Clinical Nutrition (2005) 24, 502–509
- Weimann A., Braga M.,. Harsanyi L,. Laviano A, Ljungqvist O., Soeters P., Jauch K.W., Kemen M., Hiesmayr J.M., Horbach T., Kuse E.R., Vestweber K.H., ESPEN Guidelines on Enteral Nutrition: Surgery including Organ Transplantation, Clinical Nutrition (2006) 25, 224–244






