Введение
Нормальным уровнем внутрибрюшного давления (ВБД) для пациентов, находящихся в критическом состоянии, являются значения 5-7 мм.рт.ст. Устойчивое или повторяющееся повышение ВБД выше 12 мм.рт.ст. является внутрибрюшной гипертензией (ВБГ) [1].
Выделяют 4 степени ВБГ в зависимости от величины ВБД: I степень – 12-15 мм.рт.ст.; II степень – 16-20 мм.рт.ст.; III степень – 21-25 мм.рт.ст.; IV степень > 25 мм.рт.ст. [1]. ВБГ III, IV степени в сочетании с признаками вновь развившейся органной дисфункции является абдоминальным компартмент синдромом (АКС) [1]. При АКС развивается полиорганная недостаточность - дыхательная, сердечно-сосудистая, почечная, печеночная недостаточность [2, 3]. Причинами органной дисфункции являются или само по себе повышение давления в брюшной полости, ведущее к увеличению плеврального давления, снижению сердечного выброса и снижению респираторного комплайенса, или транслокация бактерий при формировании ишемии кишечной стенки [4, 5]. Если АКС развивается у пациентов с патологией брюшной полости, забрюшинного пространства или таза, то это – первичный АКС, если он развивается у больных с другой патологией, то это – вторичный АКС. Абдоминальное перфузионнное давление (АПД) является разницей среднего артериального давления и ВБД.
ВБГ и, в частности, АКС достоверно ухудшают течение критического состояния, и исходы заболевания, а также могут быть непосредственной причиной летального исхода [2, 6]. Это является основанием считать ВБГ и, в особенности, АКС ургентными состояниями, требующими незамедлительной коррекции. Алгоритм лечения ВБГ, рекомендованный международным обществом по изучению АКС, представлен на рисунке 1 [1].
Взаимоотношения между внутрибрюшным давлением и центральной нервной системой (ЦНС) являются малоизученными и представляют значительный интерес. Этой проблеме и посвящен настоящий литературный обзор.
Внутрибрюшное давление и центральная нервная система
Внутрибрюшная и внутричерепная гипертензия
Работы, посвященные проблеме ВБГ, появились еще в начале XX века [7], однако, взаимоотношения между ВБД и ЦНС начали изучаться только в конце прошлого века. Первыми были исследователи Университета Бостона - Josephs LG с соавт, которые в 1994 году в лабораторных условиях изучили влияние пневмоперетонеума на динамику ВЧД [8]. Производилось нагнетание углекислого газа в брюшную полость до достижения ВБД 15 мм.рт.ст. и параллельное измерение ВЧД. В исследование было включено две группы животных. В первой группе головной мозг был интактным, во второй – моделировалась повреждение головного мозга при помощи раздувания эпидурально введенного баллона. ВЧД в первой группе возрастало с 13,46 ± 1,01 мм.рт.ст до 18,72 ± 1,5 мм.рт.ст, а во второй - с 22 ± 1,75 мм.рт.ст до 27,4 ± 0,93 мм.рт.ст. Повышение ВЧД в обеих группах было статистически достоверным. Авторы предположили, что сначала ВБГ увеличивает плевральное давление (ПД), а затем - центральное венозное давление (ЦВД). Это приводит к затруднению венозного оттока из полости черепа. Ухудшение оттока крови, по мнению авторов, являлось непосредственной причиной повышения ВЧД. Это предположение основывалось на доктрине Монро-Келли, которая гласит, что ВЧД обусловлено тремя составляющими – паренхима головного мозга, ликвор и кровеносные сосуды с находящейся в их полости кровью [9, 10]. Для того, чтобы ВЧД оставалось в пределах нормы при увеличении объема любого из этих составляющих, объем двух других компонентов должен уменьшиться, поскольку черепная коробка ригидна. Этим механизмом обусловлен и комплайенс мозга, и его компенсаторные способности, направленные на поддержание нормального уровня ВЧД [11]. Исходя из этой концепции, у животных первой группы с интактным мозгом ухудшение венозного оттока компенсировалось за счет уменьшения объема других компонентов полости черепа. В результате, ВЧД увеличивалось, но не достигало уровня ВЧГ. У животных второй группы еще до формирования ВБГ уже существовала ВЧГ, поэтому они не имели возможности компенсации повышенного, вследствие ухудшения венозного оттока, ВЧД. Именно это стало причиной значимого нарастания ВЧГ.
В 1996 году Bloomfield GL с соавт. провели исследование, в котором уточнялись механизмы повышения ВЧД при ВБГ, и изучались взаимоотношения между ВБД, ПД, ЦВД, сердечным выбросом (СВ) и ВЧД [12]. Лабораторным животным повышали ВБД до 25 мм.рт.ст. при помощи баллона, введенного в брюшную полость. При этом проводили динамическое измерение ПД, ЦВД, СВ и ВЧД с церебральным перфузионным давлением (ЦПД). Авторы показали, что при создании ВБГ происходило увеличение ВЧД с 7,6 ± 1,2 мм.рт.ст. до 21,4 ± 1,0 мм.рт.ст. Увеличивались также и ПД вместе с ЦВД, тогда как СВ и ЦПД достоверно уменьшались. При выполнении животным декомпрессивной лапаротомии ВБД возвращалось фактически к исходному уровню – 11,2 ± 1,8 мм.рт.ст. Вместе с этим происходила нормализация ПД, ЦВД, СИ и ЦПД. Эта работа, по-сути, подтвердила гипотезу Josephs LG с соавт о том, что причиной ВЧГ при ВБГ является нарушение венозного оттока при снижении торакоабдоминального комплаенса. Еще одним важным результатом этой работы стало демонстрация того, что само по себе повышение ВБД до 25 мм.рт.ст. способно привести к развитию ВЧГ даже у животных с интактным мозгом.
Первые клинические работы, посвященные изучению взаимоотношений ВБД и ВЧД, так же, как и лабораторные исследования, появились в конце прошлого века, когда в 1995 году вышли в свет два клинических наблюдения. В первом из них Bloomfield GL с соавт описали эффективное снижение высокого ВЧД, резистентного к проводимой интенсивной терапии, непосредственно после выполнения декомпрессивной лапаротомии у пациента с тяжелой сочетанной травмой [13]. Во втором клиническом наблюдении Irgau I с соавт описали остро развившийся выраженный подъем ВЧД у пациента с тяжелой сочетанной травмой в ответ на формирование пневмоперетонеума для выполнения холицистэктомии [14].
В 2001 году Citerio G с соавт провели исследование у 15 пациентов с тяжелой ЧМТ [15]. На живот пациентам выкладывался 15-литровый мешок с водой. Критериями включения пациентов в исследование был подострый период ЧМТ и стабилизация их состояния, под которой понимался, как минимум 24-часовой период с нормальными значениями ВЧД и ЦПД. Во время исследования производился многопараметрический церебральный мониторинг, мониторинг центральной гемодинамики и, конечно - измерение ВБД. Все параметры фиксировались до, во время и спустя 20 минут после искусственного повышения ВБД. Авторы установили, что повышение ВБД с 4,7 ± 9,9 мм.рт.ст. до 15,4 ± 4,1 мм.рт.ст. (p<0.001) приводило к незамедлительному увеличению ЦВД с 6,2 ± 2,4 мм.рт.ст. до 10,4 ± 2,9 (p<0.001) мм.рт.ст. и ВЧД - с 12,0 ± 4,2 мм.рт.ст. до 15,5 ± 4,4 (p<0.001) мм.рт.ст. Требовалось всего несколько секунд для повышения давлений, которые сохранялись на уровне плато до момента, когда убирался груз с живота. Затем происходило незамедлительное возвращение всех давлений к исходному уровню.
Кроме вышеописанных опций мониторинга авторы измеряли комплайенс дыхательной системы и торакальное трансмуральное давление. Было выявлено снижение комплайенса дыхательной системы с 58,9 ± 9,8 мл/см Н2О до 44,9 ± 9,4 мл/см Н2О. При этом торакальное трансмуральное давление, являющееся разницей между ЦВД и внутрипищеводным давлением, оставалось стабильным, а комплайенс грудной клетки достоверно снижался – с 204,7 ± 37,1 мл/см Н2О до 123,6 ± 38,0 мл/см Н2О. Интерпретируя эти результаты, авторы пришли к выводу, что повышение ВБД приводит к смещению диафрагмы вверх и, соответственно, снижению комплайенса грудной клетки. Другими словами, повышение давления в брюшной полости ведет к повышению давления в грудной полости, увеличению ЦВД, ухудшению оттока крови из полости черепа и, в конечном счете, к повышению ВЧД.
Механизм повышения ВЧД при затруднении венозного оттока из полости черепа был описан Huseby JS с соавт еще в 1981 году [16]. Авторы в своем исследовании показали, что повышение давления во внутренней яремной вене увеличивает давление в верхнем сагиттальном синусе и корковых мостиковых венах. В итоге, происходит повышение давления во всех отделах венозной системы мозга и увеличение интракраниального объема крови. В результате, повышается ВЧД.
Проведенные в конце 90-х – начале 2000-х годов работы позволили рекомендовать для рутинной клинической практики, во-первых, проводить измерения ВБД для своевременного выявления потенциально курабельных причин повышения ВЧД у пациентов с ЧМТ, и, во-вторых, соблюдать особую осторожность при необходимости использования лапароскопических методик у пациентов с сочетанной – черепно-мозговой и абдоминальной травмой [11]. Эти рекомендации актуальны, поскольку сочетание черепно-мозговой и абдоминальной травмы является частым. По данным различных авторов, частота такой сочетанности достигает 30 – 40% [17, 18].
В 2004 году Joseph DK с соавт опубликовали большую серию наблюдений, состоящую из 17 пациентов с тяжелой ЧМТ, резистентной к проводимой терапии ВЧГ (30,0 ± 8,1 мм.рт.ст.), и ВБГ (27,5 ± 5,2 мм.рт.ст.) [19]. Авторы показали, что декомпрессивная лапаротомия является эффективным методом не только нормализации ВБД, но и ВЧД. Лапаротомия позволила снизить ВБД до 21,4 ± 1,0 мм.рт.ст. У 6 пациентов с транзиторным снижением ВЧД был летальный исход, тогда как 11 больных с устойчивой нормализацией ВЧД выжили.
В 2004 – 2005 годах бельгийские ученые Malbrain M с соавт и Deeren DH с соавт провели два исследования, в которых изучались взаимоотношения между ВБД и ВЧД у пациентов с повреждением мозга нетравматического генеза [20, 21]. Как и для пациентов с ЧМТ, для больных с ишемическим, геморрагическим инсультами и метаболической энцефалопатией была характерна прямая корреляция между уровнем ВБД и значением ВЧД. Кроме этого, авторы этих исследований ведут активное обсуждение интракраниальных взаимоотношений, в частности, - зависимости давление – объем. Эта зависимость нелинейна. Другими словами, при наличии у пациента повышенного ВЧД даже незначительное увеличение объема в полости черепа приводит к развитию выраженной ВЧГ, часто резистентной к интенсивной терапии. Роль такого фактора, незначительно увеличивающего интракраниальный объем у пациента, находящегося в критическом состоянии, вполне может выполнять увеличение интракраниального объема крови вследствие ухудшения венозного оттока из полости черепа вследствие ВБГ. Этот клинический сценарий более чем вероятен с учетом того, что ВБГ развивается у 54-65% пациентов, находящихся в критическом состоянии [22].
Подтверждением того, что интерес клиницистов к проблеме ВБГ у нейрохирургических пациентов остается крайне высоким, является клиническое наблюдение, опубликованное в 2011 году в журнале Neurocritical Care [23]. Авторы приводят описание клинической ситуации, ставшей уже классической, когда декомпрессивная лапаротомия у пациента с тяжелой сочетанной травмой позволила нормализовать резистентную к проводимой терапии ВЧГ.
Центральная нервная система и внутрибрюшное давление.
Очевидна гипотетическая вероятность вторичного повышения ВБД у пациентов с неврологической или нейрохирургической патологией и первичным повреждением различных отделов мозга. Однако нам не удалось найти работ, которые бы таким образом рассматривали взаимосвязь ЦНС и ВБД. В течение последнего года мы опубликовали 2 работы, посвященные этой проблеме. Первая работа – это клиническое наблюдение, в котором описано развитие вторичного АКС у пациента с интра-экстравентрикулярной краниофарингиомой и осложненным течением послеоперационного периода [24]. У этого пациента после операции наросла неврологическая симптоматика, а затем развился АКС. ВБД удалось нормализовать при помощи продленной эпидуральной анестезии (ЭА) на нижнегрудном уровне. Постепенно был достигнут регресс неврологической симптоматики. Мы пришли к выводу, что при осложненном течении послеоперационного периода у пациентов с опухолями хиазмально-селлярной области (ХСО) возможно развитие ВБГ, которая, в свою очередь, утяжеляет течение послеоперационного периода и состояние пациента и может ухудшать исход заболевания.
Анализ этого клинического наблюдения позволил нам создать дизайн проспективного исследования [25]. Объектом исследования стали пациенты с опухолями ХСО и осложненным течением послеоперационного периода. Целью исследования было определение эффективности консервативной терапии и ЭА для коррекции ВБГ у пациентов с опухолями ХСО и осложненным течением послеоперационного периода. Вместе с этим изучались причины и механизм развития ВБГ у этой категории пациентов. В результате, было выявлено, что ВБГ развивалась у 68,3% пациентов, при этом АКС развивался у 22% больных. Это соответствует декларируемой другими авторами частоте развития ВБГ у пациентов, находящихся в критическом состоянии [17]. Такое соответствие вряд ли является случайным. До сих пор отсутствует общепринятое мнение о причинах столь частого развития ВБГ у пациентов, находящихся в критическом состоянии. В то же время, известно, что частота церебральной дисфункции, развившейся вследствие критического состояния, у пациентов с первично интактной нервной системой достигает 60 – 80% [26, 27, 28]. Возможно, развивающаяся вследствие критического состояния церебральная дисфункция вызывает или утяжеляет течение ВБГ.
Механизмом развития ВБГ во всех наблюдениях нашего исследования было формирование различных вариантов нарушения моторики желудочно-кишечного тракта (ЖКТ), которые манифестировали одновременно с повышением ВБД и сохранялись дольше, чем ВБГ. Причиной развития нарушений моторики ЖКТ, вероятнее всего, является утрата контроля диэнцефальных структур над функцией ЖКТ. Также возможной причиной является формирование дисгормональных нарушений, прежде всего, гипотиреоза, или, что наиболее вероятно, сочетание этих причин.
Консервативная терапия ВБГ, не достигшей уровня АКС, была эффективна в подавляющем большинстве наблюдений. Однако, при развитии АКС, который был зафиксирован у 9 пациентов, консервативная терапия, как правило, оказывалась неэффективной. Она была эффективной только в двух наблюдениях. При неэффективности консервативной терапии выполнялась ЭА. Противопоказанием для ЭА был сепсис, который развивался у 2 больных с АКС. Таким образом, из 9 пациентов с АКС в 4 наблюдениях проводилась ЭА, которая эффективно корригировала ВБГ у всех этих больных. Кроме этого, исходы пациентов с АКС, которым проводилась ЭА, были существенно лучше исходов пациентов с АКС, но которым ЭА не проводилась по различным причинам. Эти результаты позволяют включить ЭА в международный алгоритм коррекции ВБГ, который приведен на Рисунке 1. Однако полученные обнадеживающие результаты при проведении исследования у пациентов с опухолями ХСО, являются обоснованием для проведения дальнейших работ, объектом которых должны стать пациенты с другой нейрохирургической и неврологической патологией.
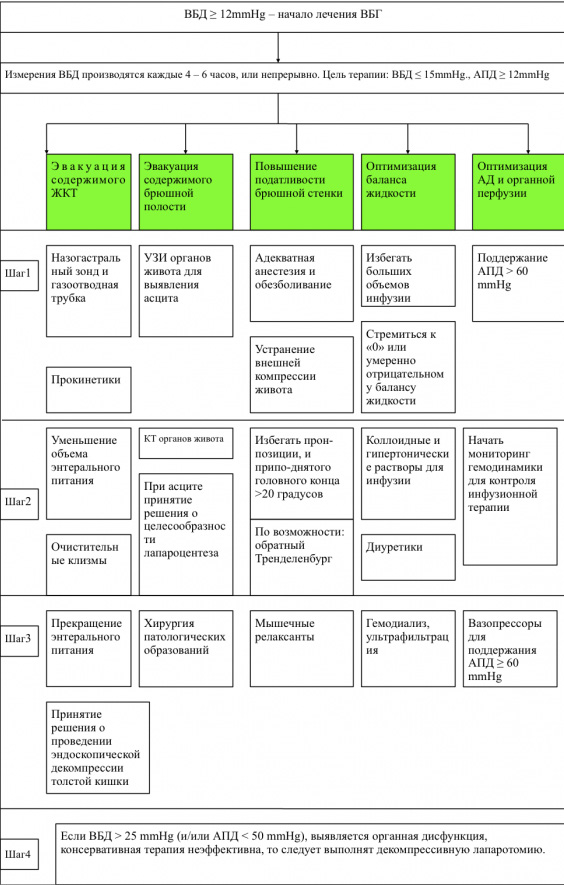
Заключение
Внутрибрюшная гипертензия приводит к развитию внутричерепной гипертензии за счет повышения внутриплеврального давления, центрального венозного давления и ухудшения венозного оттока из полости черепа. Зависимость между ВБГ и ВЧГ носит нелинейный характер, и описывается классическими для интракраниальной ситуации взаимоотношениями давление – объем.
ВБД необходимо измерять у пациентов с ВЧГ, поскольку ВБГ является одним из курабельных факторов, коррекция которых может драматично нормализовать резистентную ВЧГ.
Повреждения хиазмально-селлярной области могут приводить к развитию ВБГ различной степени выраженности и АКС, в том числе. Продленная эпидуральная анестезия на нижнегрудном уровне может явиться перспективным направлением коррекции ВБГ у этой категории больных. Проведение дальнейших исследований, посвященных проблеме ВБГ у пациентов с первичным повреждением ЦНС, оправдано и целесообразно.
Литература
- Malbrain ML, Cheatham ML, Kirkpatrick A, et al. Results from the International Conference of Experts on Intra-abdominal Hypertension and Abdominal Compartment Syndrome. I. Definitions.// Intensive Care Med. 2006; № 32: p1722–1732
- Malbrain ML, Cheatham ML, Kirkpatrick A, et al. Results from the International Conference of Experts on Intra-abdominal Hypertension and Abdominal Compartment Syndrome. II. Recommendations.// Intensive Care Med. 2007; № 33: p 951–962.
- Cheatham ML Intra-abdominal hypertension and abdominal compartment syndrome.// New Horiz.; 1999: № 7 р 96–115.
- Rosin D, Rosenthal RJ. Adverse hemodynamic effects of intraabdominal pressure-all in the head? // Int J Surg Investig. 2001; № 2: p335-345.
- Malbrain ML, Chiumello D, Pelosi P, et al. Prevalence of intra-abdominal hypertension in critically ill patients: a multicentre epidemiological study. Intensive Care Med. 2004; № 30: p 822–829.
- Hagiwara A, Fukushima H, Inoue T, et al. Brain death due to abdominal compartment syndrome cause massive venous bleeding in a patient with a stable pelvic fracture: report of a case.// Surg Today. 2004; № 34: p82-85.
- Emerson H. Intra-abdominal pressures. Arch Intern Med. 1911;7:754-84.
- Josephs LG, Este-McDonald JR, Birkett DH, et al. Diagnostic laparoscopy increases intracranial pressure. J Trauma 1994; 36(6):815-818. 9. Monro A. Observations on the structure and function of the nervous system. Edinburgh: Creech & Johnson, 1783.
- Mokri B. The Monro-Kellie hypothesis: applications in CSF volume depletion. Neurology 2001;56(12):1746–1748.
- Citerio G, Berra L. Intra-abdominal hypertension and the central nervous system. From Abdominal compartment syndrome, edited by Ivatury RR, Cheatham ML, Malbrain M, Sugrue.// Landes Bioscience. 2006;Texas.
- Bloomfield GL, Ridings PC, Blocher CR, et al. Effects of increased intra-abdominal pressure upon intracranial and cerebral perfusion pressure before and after volume expansion. J Trauma 1996; 40(6):936-941.
- Bloomfield GL, Dalton JM, Sugerman HJ, et al. Treatment of increasing intracranial pressure secondary to the acute abdominal compartment syndrome in a patient with combined abdominal and head trauma. J Trauma 1995; 39(6):1168-1170.
- Irgau I, Koyfman Y, Tikellis JI. Elective intraoperative intracranial pressure monitoring during laparoscopic cholecystectomy. Arch Surg 1995; 130(9):1011-1013.
- Citerio G, Vascotto E, Villa F, et al. Induced abdominal compartment syndrome increases intracranial pressure in neurotrauma patients: A prospective study. Crit Care Med 2001; 29(7):1466-1471.
- Huseby JS, Luce JM, Cary JM, et al. Effects of positive end-expiratory pressure on intracranial pressure in dogs with intracranial hypertension. J Neurosurg 1981; 55)5):704-705.
- Gennarelli TA, Champion HR, copes WS, et al. Comparison of mortality, morbidity, and severity of 59,713 head injured patients with 114,447 patients with extracranial injures. J Trauma 1994; 37(6):962-968.
- Citerio G, Stocchetti N, Cormio M, et al. Neuro-Link, a computer-assisted database for head injury in intensive care. Acta Neurochir (wien) 2000; 142(7):769-776.
- Joseph DK, Dutton RP, Aarabi B, et al. Decompressive laparotomy to treat intractable intracranial hypertension after traumatic brain injury. J Trauma 2004; 57(4):687-695.
- Malbrain ML, Chiumbello D, Pelosi P, et al. Prevalence of intra-abdominal hypertension in critically ill patients: A multicenter epidemiological study. Intensive Care Med 2004; 30(5):822-829.
- Deeren DH, Dits H, Malbrain ML. Correlation between intra-abdominal and intracranial pressure in nontraumatic brain injury. Intensive Care Med. 2005:31(11), 1577-1581.
- Andrews PJ, Citerio G. Intracranial pressure. Part one: Historical overview and basic concepts. Intensive Care Med 2004; 30(9):1730-1733.
- Dorfman JD, Burns JD, Green DM, et al. Decompressive laparotomy for refractory intracranial hypertension after traumatic brain injury. Neurocrit Care, 2011, ahead of print.
- Попугаев КА, Савин ИА, Горячев АС и соавт. Внутрибрюшная гипертензия и вторичный абдоминальный компартмент-синдром у пациента с краниофарингиомой в послеоперационном периоде. Вопросы нейрохирургии, 2011, 1:66-71.
- Попугаев КА, Савин ИА, Горячев АС и соавт. Вторичный абдоминальный компартмент синдром при осложненном течении послеоперационного периода у больных с опухолями хиазмально-селлярной локализации. Анестезиология и реаниматология, 2011, №4, принята в печать.
- Ely EW, Inouye SK, Bernard GR, et al. Delirium in mechanically ventilated patients: validity and reliability of the confusion assessment method for the intensive care unit (CAM-ICU). JAMA 2001, 286:2703–2710
- Ely EW, Margolin R, Francis J, et al. Evaluation of delirium in critically ill patients: validation of the Confusion Assessment Method for the Intensive Care Unit (CAM-ICU). Crit Care Med 2001, 29:1370–1379.
- Thomason JW, Shintani A, Peterson JF, et al. Intensive care unit delirium is an independent predictor of longer hospital stay: a prospective analysis of 261 non-ventilated patients. Crit Care 2005, 9:R375–R381.






