Введение
В крупных рандомизированных исследованиях было доказано нейропротективное действие индуцированной гипотермии (ИГ) у пациентов с остановкой сердечной деятельности и новорожденных с перинатальным гипоксически-ишемическим повреждением мозга [4, 28].
Лихорадка развивается у 50-80% пациентов с поврежденным мозгом в остром периоде заболевания [10, 20]. Являясь фактором вторичного повреждения головного мозга, лихорадка ухудшает исходы у нейрореанимационных пациентов [34]. Для лечения лихорадки в отделениях реанимации в последние годы применяют индуцированную нормотермию (ИН).
Доказано, что ИГ/ИН снижает потребление кислорода мозгом, уменьшает сосудистую проницаемость, снижает концентрацию возбуждающих аминокислот и свободных радикалов, блокирует запуск запрограммированной гибели клеток (апоптоз) и реакции воспаления, стабилизирует гематоэнцефалический барьер [24].
В настоящее время для охлаждения в клинике применяется ряд методик, которые можно разделить на наружные и внутривенные [29]. Одной из наиболее эффективных и безопасных методик на сегодня является система для катетерного внутривенного охлаждения CoolGard (CG) [36]. Мы сообщаем о нашем опыте использования этой системы в условиях отделения нейрореанимации.
Материалы и методы
В период с декабря 2009 года по май 2010 года в отделении реанимации Института Нейрохирургии имени НН Бурденко система CG была установлена 10 пациентам для проведения ИГ или ИН (Таблица). Показаниями для ИГ являлись следующие состояния:
Внутричерепная гипертензия (ВЧГ), резистентная к другим методам интенсивной терапии.
Острое ишемическое или гипоксическое повреждение мозга, развившееся не позднее 6 ч до начала охлаждения.
Искусственная гипотермия
В нашем отделении принят следующий протокол проведения ИГ: 1. Пациенту должна проводиться ИВЛ. 2. Установка системы CG: катетеризация бедренной вены и мочевого пузыря. 3. Седация пропофолом или мидозоламом в комбинации с наркотическими анальгетиками (фентанил). Если, несмотря на седацию, развивается мышечная дрожь вводят миорелаксанты (пипекуроний). 4. Установка целевой температуры 32° С и максимальной скорости охлаждения. 5. Для максимально быстрой индукции гипотермии проводится внутривенная инфузия ледяного физиологического раствора в дозе 30 мл/кг в течение 30 мин. 6. Длительность ИГ составляет 1-5 суток в зависимости от клинической ситуации. 7. Скорость согревания не должна превышать 0,05 – 0,1°С /ч.
ИГ проводилась у 5 пациентов (Таблица). Характеристика пациентов, у которых была использована система Cool Gard для охлаждения.
- Пол - 1*
- Возраст - 2*
- В/в инфузия холодного раствора для индукции гипотермии - 3*
- Время достижения целевой температуры - 4*
- Продол-жительность охлаждения - 5*
| 1* | 2* | Диагноз | Режим охлаждения и показания | 3* | 4* | Комбинация с другими методами охлаждения | 5* | Осложнения / побочные эффекты / технические проблемы | ИН после ИГ | Седация и цель седации | Исход |
| Ж | 41 | Клипирование аневризмы ВСА с длительным временным треппингом ВСА | ИГ: церебропротек- ция | Да | 3,5 часа | Нет | 2 сут | Нет | Нет | Снижение метаболичес-ких потребностей, купирование мышечной дрожи | Переведена в н/х отделение на 9 сутки п/о, выписана из Института на 23 сут ки п/о ШИГ - 4 |
| Ж | 8 | Интраоперационный разрыв АВМ левой затылочной области | ИГ: коррекции ВЧГ | Да | 2 часа | Нет | 2 сут | Нет | Нет | Да: коррекции ВЧГ | Летальный на 7 сут ки после операции. ШИГ-1 |
| М | 26 | ЧМТ | ИГ: коррекции ВЧГ | Да | 18 часов | Наружное охлаждение | 5 сут | Нет | Да, 4 сут | Да: коррекции ВЧГ | Переведен в н/х отделение на 20 сутки, выписан из Института на 49 сутки ШИГ - 3 |
| М | 18 | ЧМТ | ИГ: коррекции ВЧГ | Да | 4 часа | Нет | 3 сут | Нет | Нет | Да: коррекции ВЧГ | Переведен в н/х отделение на 19 сутки, выписан из Института на 53 сутки ШИГ - 4 |
| Ж | 31 | ЧМТ | ИГ: коррекции ВЧГ | Да | 4,5 часа | Нет | 4 сут | Поломка температур-ного датчика | Да, 3 сут | Да: коррекции ВЧГ | Переведена в н/х отделение на 31 сутки, выписана из Института на 41 сут ки ШИГ - 3 |
| Ж | 17 | ЧМТ. Аспирационная пневмония | ИН: лихорадка в остром периоде ЧМТ | Нет | 6 часов | Нет | 7 сут | Нет | Да: в рамках коррекции ВЧГ | Переведена в н/х отделение на 22 сутки, выписана из Института на 52 сут ки ШИГ - 3 | |
| М | 28 | ЧМТ. Менингоэнцефалит | ИН: лихорадка в остром периоде ЧМТ | Нет | 5 часов | Нет | 5 сут | Нет | Нет | Переведен в н/х отделение на 23 сутки, выписан из Института на 56 сутки ШИГ - 4 | |
| Ж | 47 | Удаление экстравен-трикулярной краниофарингиомы | ИН: лихорадка центрального генеза в раннем п/о периоде | Нет | 5,5 часов | Нет | 7 сут | Нет | Нет | Переведена в н/х отделение на 38 сутки п/о, выписана из Института на 87 сутки п/о ШИГ - 3 | |
| Ж | 25 | Удаление интра-экстравен-трикулярной краниио-фарингиомы | ИН: лихорадка центрального генеза в раннем п/о периоде | Нет | 6,5 часов | Нет | 7 сут | Поломка температур-ного датчика | Нет | Переведена в н/х отделение на 35 сутки п/о, выписана из Института на 89 сут ки п/о ШИГ - 3 | |
| Ж | 14 | Удаление злокачественной глиомы III желудочка | ИН: лихорадка в раннем послеоперационном периоде | Нет | 5 часов | Нет | 7 сут | ТЭЛА | Нет | Летальный исход на 8 сутки п/о вследствие ТЭЛА ШИГ - 1 |
Примечание: ЧМТ – черепно-мозговая травма; ИН – индуцированная нормотермия; ИГ – индуцированная гипотермия; ВЧГ – внутричерепная гипертензия; ШИГ – шкала исходов Глазго; н/х – нейрохирургический; АВМ – артериовенозная мальформация; ВСА – внутренняя сонная артерия; п/о – послеоперационный; ТЭЛА – тромбоэмболия легочной артерии. Зеленым цветом веделены пациенты, которым проводилась индуцированная гипотермия, синим – пациенты с индуцированной нормотермией.
В одном наблюдении она использовалась для защиты головного мозга от ишемического повреждения (наблюдение 1), в остальных – для коррекции ВЧГ (наблюдения 2, 3, 4, 5). В наблюдении 2 причиной устойчивой ВЧГ, несмотря на дренирование обоих боковых желудочков, была гемотампонада желудочковой системы. Наблюдения 3, 4, 5 - это пациенты с тяжелой черепно-мозговой травмой (ЧМТ), у которых ВЧГ было невозможно устранить менее агрессивными методами интенсивной терапии. В наблюдении 5 ИГ позволила избежать выполнения наружной декомпрессивной трепанации с пластикой твердой мозговой оболочки, а в наблюдениях 3 и 4 декомпрессивная трепанация была выполнена. Среди этих трех пациентов только у одного (наблюдение 3) для достижения гипотермии было недостаточным использование системы CG и инфузии ледяного физиологического раствора, что потребовало дополнительного использования наружного охлаждения. Ниже приведено описание наблюдений 1, 2, 3.
Наблюдение 1 (проведение ИГ для защиты головного мозга)
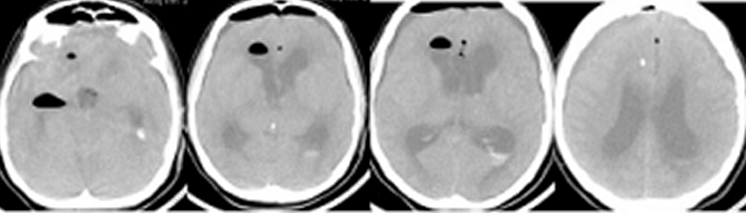
Пациентка Ч, 41 года, поступила в Институт с диагнозом: множественные аневризмы сосудов головного мозга – гигантская эксцентричная фузиформная аневризма области бифуркации левой ВСА с распространением на М1 сегмент левой СМА и аневризма небольших размеров развилки правой ВСА, рецидивирующие субарахноидальные кровоизлияния (САК), подострая внутримозговая гематома области Сильвиевой щели слева. Пациентка дважды переносила САК из аневризмы левой ВСА: за 1,5 месяца и 7 суток до госпитализации в Институт. При поступлении больная предъявляла жалобы на умеренную головную боль, очаговой неврологической симптоматики не выявлялось, по шкале Ханта-Хесса тяжесть состояния оценивалась в 1 балл. Ввиду гигантского размера и фузиформного характера аневризмы операция была технически сложной: проводилось многократное временное клипирование (по 5-7 мин) задней соединительной артерии, левой передней мозговой артерии, общей и наружной сонной артерии на шее, многократное репозиционирование клипсов на шейке аневризмы, внутрисосудистая аспирация крови из левой внутренней сонной артерии. По данным допплерографии наблюдалось преходящее снижение кровотока в дистальных отделах М1 сегмента левой СМА, что потребовало дополнительного пережатия общей и наружной сонной артерии на шее в течение 9 мин. Была также удалена гематома левой височной доли. Через 1,5 часа после завершения операции на фоне пробуждения из наркозного сна и появления реакции на интубационную трубку выявлялся правосторонний гемипарез, инструкций пациентка не выполняла. В контексте особенностей проведенной операции состояние было расценено как формирующееся ишемическое повреждение мозга, и было принято решение о незамедлительном начале ИГ для защиты головного мозга. ИГ проводилась в соответствии с описанным выше протоколом. КТ головного мозга выявило послеоперационные изменения (Рисунок 1).
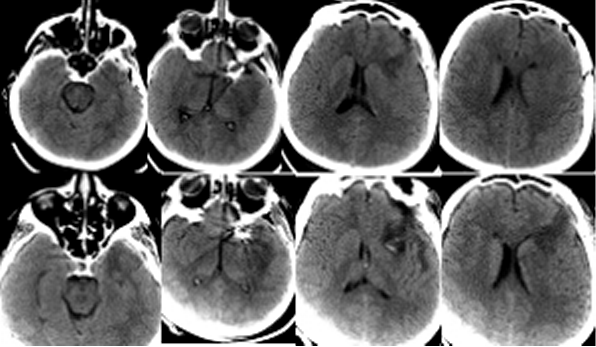
Через 1,5 часа после завершения операции на фоне пробуждения из наркозного сна и появления реакции на интубационную трубку выявлялся правосторонний гемипарез, инструкций пациентка не выполняла. Состояние было расценено, как формирующееся ишемическое повреждение мозга, и было принято решение о незамедлительном начале ИГ для защиты головного мозга. ИГ проводилась в соответствии с описанным выше протоколом. Гипотермия была достигнута в течение 3,5 часов. Гемодинамика была стабильной. Проводилось энтеральное питание. Лабораторные показатели были в пределах нормы. Гипотермия продолжалась в течение 2 суток, после чего было начато согревание. Седация была прекращена при достижении нормотермии. Неврологический дефицит отчетливо регрессировал: восстановились сознание и движения в правых конечностях. При контрольном КТ-исследовании головного мозга очагов ишемии не выявлялось (Рисунок 1). Температура оставалась в пределах нормы, поэтому охлаждающий катетер был удален на следующий день. Осложнений ИГ не было. ИВЛ продолжалась еще в течение 4 суток. После экстубации пациентка наблюдалась в отделении реанимации еще 2 суток. Из Института больная выписана на 23 сутки после операции в удовлетворительном состоянии без очагового неврологического дефицита.
Наблюдение 2
(проведение ИГ для коррекции ВЧГ у пациентки с внутримозговой гематомой и прорывом крови в желудочковую систему. Пациентка Т, 8 лет, поступила в Институт с диагнозом: Артерио-венозная мальформация левой теменно-височной области. У пациентки выявлялся судорожный синдром, резистентный к проводимой терапии аниконвульсантами. Очаговой неврологической симптоматики не было. Во время эндовазальной эмболизации АВМ, после ее частичной окклюзии, произошел разрыв мальформации с прорывом крови в желудочковую систему. Был установлен наружный вентрикулярный дренаж в левый боковой желудочек, и пациентка переведена в отделение реанимации в состоянии седации на ИВЛ. Зрачки были узкими. При КТ головного мозга выявлена гемотампонада желудочковой системы. Исходя из полученных при КТ данных, был установлен наружный вентрикулярный дренаж в правый боковой желудочек и паренхиматозный датчик ВЧД (Codman, USA) (Рисунок 2). В связи с внутричерепной гипертензией (ВЧД: 25-35 мм.рт.ст.) и неэффективностью осмотерапии было принято решение о проведении ИГ по выше приведенному протоколу. Целевая температура была достигнута через 2 часа после начала охлаждения. В течение суток удавалось поддерживать нормальные значения ВЧД, несмотря на выраженную гемотампонаду желудочков. На вторые сутки развилась устойчивая ВЧГ и произошло вклинение. Гипотермия и седация были прекращены, верифицирована смерть мозга. Пациентка скончалась на 7 сутки после операции.
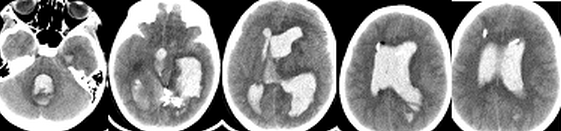
Наблюдение 3 (проведение ИГ для коррекции ВЧГ у пациента с ЧМТ).
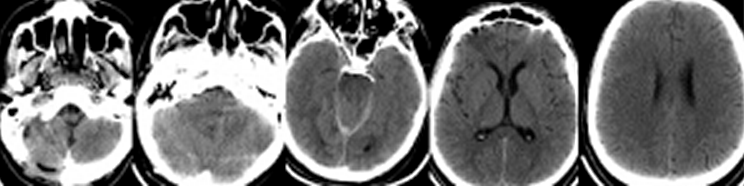
Пациент Д, 26 лет, был переведен в Институт из стационара первичной госпитализации на третьи сутки после травмы с диагнозом: Тяжелая открытая ЧМТ, ушиб головного мозга, вдавленный перелом костей черепа в теменной области по средней линии. Из анамнеза было известно, что пациент был избит. При поступлении в Институт уровень сознания оценивался как сомноленция. Очагового неврологического дефицита не выявлялось. При КТ-исследовании головного мозга определялись множественные геморрагические очаги ушибов III-IV вида в правой лобно-височной области с перифокальными зонами отека. Срединные структуры были смещены влево на 5 мм, желудочковая система сужена. Конвекситальные субарахноидальные пространства правого полушария сглажены. Определялся вдаленный оскольчатый перелом в правой теменно-парасагиттальной области, линейный перелом в левой теменно-височной области и расхождение сагиттального шва (Рисунок 3).
Пациент находился в нейрохирургическом отделении. Через несколько часов после госпитализации в Институт состояние пациента стало прогрессивно ухудшаться. Развилось угнетение сознания до сопора, появилась брадикардия и артериальная гипертензия. Экстренно была выполнена операция - устранение вдавленного перелома в правой теменно-парасагиттальной области. После операции больной переведен в отделение реанимации, где был начат мониторинг ВЧД. При пробуждении развивалась внутричерепная гипертензия, поэтому проводилась седация. Продолжалась ИВЛ. Показатели гемодинамики оставались в пределах нормы. Появилась лихорадка до 39-39°С резистентная к терапии нестероидными противовоспалительными препаратами, парацетамолом и наркотическими анальгетиками. В течение суток состояние оставалось стабильным. На 2 сутки после операции (5 сутки после травмы) развилась устойчивая ВЧГ (35-40 мм.рт.ст.), резистентная к углублению седации и терапии гиперосмолярными растворами (маннитол, гиперХАЕС). Было принято решение о проведении ИГ. Была установлена система CG, начата инфузия ледяного физиологического раствора в соответствии с протоколом. Однако спустя 4 часа у пациента сохранялась температура 37-37,8°С в мочевом пузыре. Выраженность ВЧГ существенно уменьшилась, однако, ВЧД оставалось на уровне 22-25 мм.рт.ст. Это стало основанием для комбинации методов достижения гипотермии. Пациент был уложен на охлаждающий матрац с установкой целевой температуры 32°С. Вместе с этим пациенту осуществлялась инфузия пропофола, фентанила и пипекурония. Не смотря на агрессивность проводимой терапии, гипотермии удалось добиться только через 18 часов после начала охлаждения. В течение последующих 3 суток на фоне проводимой ИГ отмечались редкие эпизоды ВЧГ, которые корригировались введением гиперосмолярных растворов. Это привело к развитию гипернатриемии. В связи с этим было принято решение о выполнении декомпрессивной краниотомии с пластикой твердой мозговой оболочки на 6 сутки после первой операции (9 сутки после травмы). После краниотомии ИГ проводилась еще в течение 2 суток. ВЧГ на этапе согревания не возникало. Показатели витальных функций были в пределах нормы. Седация прекращена на следующие сутки после достижения нормотермии. Сознание восстановилось на 14 сутки после травмы, а адекватное самостоятельное дыхание – на 20 сутки. Затем пациент был переведен в нейрохирургическое отделение. На 52 сутки после травмы пациент был выписан из Института в удовлетворительном состоянии без очагового неврологического дефицита.
Искусственная нормотермия
Показанием для ИН в наших наблюдениях была резистентная к фармакологическим препаратам лихорадка у пациентов с осложненным течением раннего периода после операции или ЧМТ
В нашем отделении принят следующий протокол проведения ИН:
- Пациент может находится как на самостоятельном дыхании, так и на ИВЛ.
- Установка системы CG: катетеризация бедренной вены и мочевого пузыря.
- Установка целевой температуры 36-37 С, максимальной скорости охлаждения или режима “Fever”.
- При развитии мышечной дрожи проводится ступенчатая терапия:
- (а) обдув теплым воздухом кожных покровов –
- (б) внутривенное введение трамадола –
- (в) седация пропофолом или мидозоламом –
- (г) комбинация гипнотиков с фентанилом –
- (д) использование миорелаксантов (пипекуроний);
- Длительность зависит от длительности лихорадки, но не более 7 суток.
- Скорость согревания не должна превышать 0,5° С в час.
ИН использовалась у 5 пациентов (Таблица). В двух наблюдениях причиной лихорадки были инфекционные осложнения – пневмония, менингит (наблюдения 6, 7). В оставшихся наблюдениях у пациентов не было выявлено инфекционных осложнений, а лихорадка была обусловлена воздействием различных повреждающих факторов на диэнцефальную область (наблюдения 8, 9,10). Ниже приведено описание наблюдений 7 и 10.
Наблюдение 7 (проведение ИН в остром периоде ЧМТ в связи с развившейся лихорадкой вследствие инфекционных осложнений).
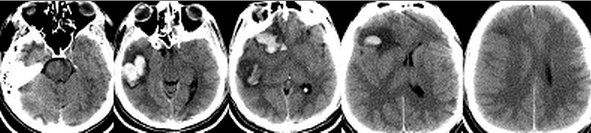
Пациент Н, 28 лет, был переведен в Институт из стационара первичной госпитализации на четвертые сутки после травмы с диагнозом: Ушиб головного мозга: лобных долей, правого полушария мозжечка, травматическое субарахноидальное кровоизлияние. Из анамнеза было известно, что пациент был избит. После кратковременного эпизода утраты сознания был период стабилизации состояния. Госпитализирован в больницу пациент был только через 6 часов после травмы, когда развилось угнетение сознания до сопора и появились мозжечковые нарушения. Тяжесть состояния продолжала нарастать, развился тетрапарез. Пациент был интубирован, началась ИВЛ. При КТ-исследовании головного мозга (по данным выписки из первичного стационара) была выявлена эпидуральная и субдуральная гематома задней черепной ямки (ЗЧЯ). Было произведено удаление гематомы с декомпрессивной трепанацией ЗЧЯ и пластикой твердой мозговой оболочки, установлен наружный вентрикулярный дренаж, который в связи с его дисфункцией позднее, перед переводом в Институт, был удален. После операции состояние оставалось тяжелым, сохранялся сопор и тетрапарез до 0-1 баллов. Была выполнена трахеостомия. На 3 сутки пациент был переведен в Институт Нейрохирургии. Уровень сознания при поступлении оценивался как сопор. Выявлялся тетрасиндром: нижняя параплегия, глубокая верхняя параплегия с возможностью ограниченного приподнимания плеч. Продолжалась ИВЛ. Появилась высокая лихорадка – 38 – 39° С. При КТ-исследовании головного мозга определялись зоны геморрагического пропитывания в базальных отделах правой гемисферы мозжечка, небольшое скопление крови субтенториально с двух сторон и в дорзальных отделах межполушарной щели, контузионные очаги в лобных долях. III желудочек был умеренно расширен. Определялся продольный линейный перелом затылочной кости протяженностью 2,5 см парамедианно справа, в 1,5 см от большого затылочного отверстия (Рисунок 4).
Был вновь установлен наружный вентрикулярный дренаж Codman с возможностью мониторинга ВЧД. При исследовании ликвора был диагностирован менингит – цитоз ликвора - 4320/3, нейтрофильный, глюкоза ликвора составила 30% от уровня глюкозы в плазме, лактат ликвора был повышен до 3,8 ммоль/л., Внутричерепной гипертензии не отмечалось. Была назначена антибактериальная терапия Меропенемом и Ванкомицином. Продолжалась ИВЛ. Несмотря на коррекцию антибактериальной терапии в течение следующих суток лихорадка стала более выраженной, достигая 40-40,5° С, резистентная к парацетамолу, НПВС и наркотическим анальгетикам. На этом фоне развилось угнетение сознание до поверхностной комы, исчезли движения плеч. Была начата ИН по вышеприведенному протоколу. Через 5 часов была достигнута нормотермия – 36,9 – 37,3° С в мочевом пузыре. Вместе с этим постепенно, в течение следующих суток у пациента повысился уровень бодрствования и спонтанной активности, вновь появились движения в плечах. ИН продолжалась в течение 5 суток. На фоне антибактериальной терапии была достигнута нормализация ликвора в течение недели, вентрикулярный дренаж был удален на 12 сутки. К этому времени уровень сознания возрос до сомноленции, восстановились движения в руках, начался регресс нижней параплегии. ИВЛ продолжалась в течение 18 суток. На 23 сутки пациент был переведен в нейрохирургическое отделение. На 25 сутки в связи с восстановлением адекватного глотания произведена декануляция. Пациент был выписан из Института на 56 сутки, по ШИГ его состояние оценивалось в 4 балла.
Наблюдение 10 (проведение ИН в остром периоде в связи с развившейся лихорадкой вследствие непосредственного воздействия на диэнцефальную область).
Пациентка Е, 14 лет, поступила в Институт с диагнозом: Опухоль III желудочка. Пациентка предъявляла жалобы на общую слабость и головную боль, выявлялось снижение зрение до сотых с двух сторон. Опухоль была удалена субтотально транскаллезным доступом. Обращало на себя внимание большое количество патологических сосудов и инфильтрация опухолью дна III желудочка. Интраоперационно был установлен наружный вентрикулярный дренаж,. При гистологическом исследовании было верифицировано, что это злокачественная глиома. После пробуждения выявлялось угнетение сознания до сопора. Пациентка выполняла простые инструкции, быстро истощалась. Выявлялся орально-стволовой синдром в виде тетрапареза, птоза, расходящегося по вертикали и горизонтали косоглазия, узких зрачков и ограничения рефлекторного взора вверх. В связи с отсутствием реакции на интубационную трубку и угнетением спонтанной дыхательной активности продолжалась ИВЛ в режиме SIMV. Обращало на себя внимание развитие в первые послеоперационные часы лихорадки до 40-41° С и грубых водно-электролитные нарушении – полиурии и гипернатриемии до 160 ммоль/л, не смотря на использование Десмопрессина и проведение адекватной инфузионной терапии. При контрольном КТ-исследовании выявлялись послеоперационные изменения: умеренная пневмоцефалия, базальные цистерны визуализировались, смещения срединных структур не было (Рисунок 5).
В связи с тем, что не было выявлено источников инфекции, было предположено, что причиной лихорадки стало интраоперационное повреждение диэнцефальных структур. Было принято решение о проведении ИН по вышеописанному протоколу. Нормотермия была достигнута в течение 5 часов, а еще через 12 часов существенно возрос уровень сознания и спонтанной активности, отмечен регресс тетрапареза, птоза и расходящегося косоглазия. Продолжалась ИВЛ. Сохранялся нестабильным водно-электролитный баланс. Однако на фоне проводимой терапии удавалось поддерживать нормальный уровень натрия в плазме, своевременно купировать полиурию и адекватно восполнять потери жидкости. ИН продолжалась в течение 7 суток. Во время использования системы CG и после удаления катетера из бедренной вены производилось динамическое ультразвуковое сканирование вен нижних конечностей, при которых не было выявлено патологических изменений. На следующие сутки после удаления катетера внезапно развилась асистолия. Реанимационные мероприятия были неэффективны. При патологоанатомическом исследовании выявлена массивная тромбоэмболия легочной артерии. Источник тромбоэмболии выявить не удалось, однако, наиболее вероятно, ТЭЛА была связана с катетером CG в нижней полой вене.
Результаты и их обсуждение
В остром периоде заболевания у многих нейрореанимационных больных может возникнуть необходимость снизить температуру, что бывает технически сложно. Лихорадка у нейрореанимационных пациентов достоверно коррелирует с неблагоприятным исходом [5]. Примерно в половине всех эпизодов лихорадки в остром периоде она не связана с инфекцией, а обусловлена непосредственным воздействием на центры терморегуляции [1]; у таких больных жаропонижающие средства эффективны не более чем 35% случаев [13, 29, 35]. Следует подчеркнуть, что у всех пациентов приведенной серии наших наблюдений фармакологическая терапия была неэффективна.
Действительно эффективными методами снижения температуры тела остаются инструментальные методы, которые можно разделить на наружные и внутривенные [29]. Такие методики наружного охлаждения, как обкладывание пациента подушками со льдом, обдув холодным воздухом при помощи фена, имеют низкую эффективность. Охлаждающие матрацы позволяют более эффективно снизить, а затем и поддерживать целевую температуру [29]. Новая система для наружного охлаждения Arctic Sun на сегодняшний день является наиболее эффективной из всех методик наружного охлаждения [12]. Следует обратить внимание на то, что различные модификации охлаждающих шлемов могут быть эффетивны только в неонатологии [17]. Для всех методик наружного охлаждения типичны следующие особенности [14, 25]: мышечная дрожь возникает фактически всегда; высокая частота инфекционных осложнений, в частности, пневмонии обусловлена не только угенетением иммунокомпетентных клеток, но и рефлекторным воздействием охлаждающей системы на поверхность грудной клетки и, соответственно, на легкие; трудность достижения целевой температуры заключается в том, что первым защитным механизмом при снижении температуры тела на 1-1,5° С является перераспределение кровотока из поверхностных сосудов вследствие их сужения, что существенно затрудняет процесс теплоотдачи; и, наконец, при работе с этими методиками существенно возрастает нагрузка на медицинский персонал, что требует дополнительного ресурса.
Внутривенные методики можно разделить на инфузию охлажденных растворов и катетерную гипотермию. Первый метод заключается в быстром, в течение 30 минут, введении ледяного физиологического раствора в дозе 30 мл/кг и пригоден исключительно для индукции ИГ/ИН. Не смотря на кажущуюся агрессивность метода, была доказана его безопасность [6, 19, 26]. Этот метод мы рутинно используем для ИГ, поскольку он позволяет быстро достигнуть целевой температуры тела, что является принципиальным для осуществления церебропротекции и эффективного снижения ВЧД. Катетерная гипотермия подходит как для индукции ТГ/ИН, так и для ее поддержания. Особенности катетерной гипотермии следующие [2, 9, 23, 30, 33, 36]: высокая эффективность и управляемость температурой тела на всех этапах гипотермии (индукция, поддержание гипотермии и согревание); реже, чем при наружной гипотермии, возникает мышечная дрожь и дискомфорт у пациента, что приводит к уменьшению потребности в введении седативных препаратов; реже развиваются инфекционные осложнения, за исключением инфекции кровотока, риск развития которого выше, чем при других методиках; повышен риск развития тромботических и тромбоэмболических осложнений; высокая стоимость расходных материалов.
Система Cool Gard (Zoll, USA) (Рисунок 6) – это в настоящее время наиболее распространенная система в отделениях нейрореанимации, которая, по данным литературы [3, 11, 16] и по нашему опыту, является относительно безопасной и эффективной методикой катетерного охлаждения. Эта методика позволяет быстро достигнуть и адекватно поддерживать целевую температуру. При этом система CG не требует дополнительного ресурса медицинского персонала, что очень важно для рутинной практики. При использовании CG в режиме ИГ потребность в седативных препаратах значительно снижается, в режиме ИН очень часто необходимость в них вообще отсутствует. Следует подчеркнуть, что при помощи CG согревание становится управляемым. Это позволяет избежать рецидивов внутричерепной гипертензии, угрожающих вклинением во время согревания. Наружные методы не позволяют так точно и удобно проводить согревание.
Эффективность ИГ была доказана только у двух категорий больных – при коме после успешной сердечно-легочной реанимации и у новорожденных с ишемически-гипоксическим повреждением центральной нервной системы [24]. В настоящее время ведется активный поиск режимов ИГ/ИН, которые окажутся эффективными у пациентов с другими заболеваниями ЦНС [22]. Несмотря на отсутствие доказанной эффективности ИГ/ИН при ЧМТ, вазоспазме после аневризматического САК, ишемическом инсульте, спинальной травме, эти методики применяются в большинстве отделений нейрореанимации во всем мире фактически рутинно [24]. Мы в нашем отделении используем ИГ/ИН при следующих состояниях: острейший период ишемического повреждения мозга, рассчитывая на нейропротективный эффект гипотермии (наблюдение 1); пациенты с резистентной ВЧГ, когда другие методы снижения ВЧД оказываются неэффективными (наблюдения 2, 3, 4, 5); пациенты в остром периоде заболевания с выраженной лихорадкой, когда другие методы снижения температуры неэффективны (наблюдения 6, 7, 8, 9, 10).
При ишемическом и гипоксическом повреждении мозга ИГ обладает нейропротективным эффектом только в том случае, если она начата в течение 6 часов после развития церебральной катастрофы [15, 21]. В наблюдении 1 индукция гипотермии была начата через 1,5 часа после длительного временного клипирования ВСА, а целевая температура была достигнута еще через 3,5 часа. Это позволило достигнуть отчетливого регресса правосторонней гемиплегии, которая сформировалась после операции.
ИГ можно рассматривать как отдельную терапевтическую опцию у пациентов с ВЧГ, резистентной к другим методам интенсивной терапии. В литератере описано эффективное использование ИГ у пациентов с ЧМТ и при злокачественном инсульте в бассейне СМА [18, 31]. Сравнимой эффективностью по нормализации ВЧД обладает только широкая декомпрессивная краниотомия с пластикой твердой мозговой оболочки [21]. В нашей серии наблюдений ИГ использовалась у 3 пострадавших с ЧМТ и резистентной ВЧГ (наблюдения 3, 4, 5). Один пациент (наблюдение 5) не потребовал выполнения декомпрессивной краниотомии, поскольку ИГ вместе с другими методами интенсивной терапии позволила эффективно контролировать ВЧД. В наблюдениях 3 и 4 после периода стабилизации ВЧД на фоне ИГ вновь стали развиваться эпизоды ВЧГ, поэтому вынужденно была выполнена краниотомия. По нашему мнению, не следует противопоставлять эти два метода эффективного контроля ВЧД. Более того, когда пациент оперируется на фоне ИГ, то не развивается одного из наиболее опасных осложнений краниотомии – пролабирования и ущемления мозгового вещества в костном дефекте [21, 27].
ИГ в связи с резистентной ВЧГ была использована еще у одного пациента нашей серии (наблюдение 2). Это ребенок с интраоперационным разрывом артерио-венозной мальформации и формированием гемотампонады желудочковой системы. Установка наружных вентрикулярных дренажей в оба боковых желудочка и весь комплекс интенсивной терапии не привели к снижению ВЧГ. ИГ позволила эффективно контролировать ВЧД в течение суток. Однако затем вновь развилась резистентная к терапии ВЧГ, произошла дислокация структур мозга и вклинение. Это наблюдение подтверждает существующее мнение, что ИГ наименее эффективна у пациентов с геморрагическим инсультом [21]. Поскольку возраст является ограничением для использования системы CG, то это наблюдение, несмотря на летальный исход, показывает что система CG в принципе может быть безопасно использована у детей.
ИН целесообразно использовать в остром периоде заболевания, когда ВЧГ на фоне лихорадки еще не успела развиться.. Было показано, что поддержание нормотермии на протяжении 14 суток у пациентов после спонтанного аневризматического субарахноидального кровоизлияния улучшает исходы заболевания [4]. Лихорадка в ранние сроки после операции, травмы или нарушения мозгового кровообращения развивается или вследствие инфекционных повреждений (пневмония, менингоэнцефалит, сепсис), или вследствие непосредственного повреждения мозга и наличия свободно излившейся крови, особенно в полость III желудочка, дно которого представляют собой ядра гипоталамуса [8]. В нашей серии наблюдений мы применяли ИН у двух пациентов с ЧМТ, у которых лихорадка развилась вследствие инфекционных осложнений (наблюдение 6, 7). При достижении нормотермии регрессирует общемозговая симптоматика, как это было в наблюдении 6. ИН при помощи системы CG была начата при устойчивом повышении температуры до 40-40,5° С. При снижении температуры до 37° С повысился уровень сознания, начался регресс тетрапареза. Еще у трех пациентов лихорадка развивалась, наиболее вероятно, вследствие непосредственного повреждения диэнцефальных структур (наблюдения 8, 9, 10). Это пациенты с опухолями хиазмально-селлярной локализации. Лихорадка у этих больных была резистентна к проводимой фармакологической терапии, а при достижении нормотермии у всех пациентов отмечалось улучшение неврологического статуса. Ни у кого из этих пациентов на развивалось мышечной дрожи и они не требовали проведения седации.
Наиболее грозным осложнением ипользования системы CG является тромботические и тробмбоэмболические осложнения [33]. В нашей серии наблюдений летальный исход у одной пациентки развился вследствие тромбоэмболии легочной артерии (наблюдение 10). Динамическое ультразвуковое сканирование вен нижних конечностей у этой больной не выявляло наличие тромбов, но полностью исключить роль катетера в генезе ТЭЛА трудно. По-видимому, оправдано раннее профилактическое назначение низкомолекулярных гепаринов [7], однако это возможно не ранее чем на 3-и сутки после открытых нейрохирургических операций из-за высокого риска геморрагических осложнений.
Выводы
Система для внутривенной катетерной гипотермии CoolGard эффективно снижает температуру тела до целевых значений у нейрореанимационных пациентов, не вызывая при этом дополнительного дискомфорта у пациента.
Система CoolGard позволяет эффективно поддерживать целевую температуру тела пациента, при этом не задействуя дополнительный ресурс медицинского персонала, что является крайне важным в рутинной практике отделения нейрореанимации.
Система CoolGard позволяет проводить управляемое согревание пациента, что снижает риск рецидивов внутричерепной гипертензии, приводящих к вклинению на этапе согревания.
Применение системы CoolGard относительно безопасно. Наиболее опасным являются тромбоэмболические осложнения, поэтому необходимо ежедневное ультрозвуковое сканирование вен нижних конечностей и по возможности раннее профилактическое использование низкомолекулярных гепаринов.
Охлаждающий катетер
Литература
- Albrecht RF II, Wass CT, Lanier WL. Occurrence of potentially detrimental temperature alterations in hospitalized patients at risk for brain injury // Mayo Clin Proc 1998; 73:629–635.
- Arrich J, The European Resuscitation Council Hypothermia After Cardiac Arrest Registry Study Group. Clinical application of mild therapeutic hypothermia after cardiac arrest. Crit Care Med 2007, 35:1041–1047.
- Badjatia N: Celsius Control system // Neurocrit Care 2004, 1:201–203.
- Badjatia N, Fernandez L, Fernandez A, et al: Impact of therapeutic normothermia on outcome after subarachnoid hemorrhage // Paper presented at: 60th Annual Meeting of the American Academy of Neurology, April 16, 2008, Chicago, IL
- Badjatia N. Hyperthermia and fever control in brain injury // Crit Care Med, 2009, 37(7): S250-S257.
- Bernard S, Buist M, Monteiro O, et al: Induced hypothermia using large volume, ice-cold intravenous fluid in comatose survivors of out-of-hospital cardiac arrest: A preliminary report // Resuscitation 2003, 56:9–13.
- Corry JJ, Dhar R, Murphy T, Diringer MN. Hypothermia for refractory status epilepticus // Neurocrit Care, 2008, 9:189-197.
- Deogaonkar A, De Georgia M, Bae C, et al. Fever is associated with third ventricular shift and intracerebral hemorrhage: Pathophysiologic implications // Neurology India, 2005, 53(2): 202-207.
- Diringer MN: Neurocritical Care Fever Reduction Trial Group. Treatment of fever in the neurologic intensive care unit with a catheter-based heat exchange system // Crit Care Med. 2004, 32:559–564.
- Diringer MN, Reaven NL, Funk SE, et al. Elevated body temperature independently contributes to increased length of stay in neurologic intensive care unit patients // Crit CareMed 2004; 32:1489–1495.
- Flint AC, Hemphill JC, Bonovich DC: Therapeutic hypothermia after cardiac arrest: Performance characteristics and safety of surface cooling with or without endovascular cooling // Neurocrit Care 2007, 7:109–118.
- Geocadin RG, Carhuapoma JR. Medivance Arctic Sun®Temperature Management System // Neurocrit. Care 2005;3:63–67
- Grosser T. Variability in the response to cyclooxygenase inhibitors: toward the individualization of nonsteroidal anti-inflammatory drug therapy // J Investig Med. 2009, 57(6):709-16.
- Hayashi N. Management of pitfalls for the successful clinical use of hypothermia treatment // Journal of Neurotrauma, 2009, 26:445-453.
- Hemmen TM, Lyden PD. Hypothermia after acute ischemic stroke // Journal of Neurotrauma, 2009, 26:387-391.
- Hinz J, Rosmus M, Popov A, et al: Effectiveness of an intravascular cooling method compared with a conventional cooling technique in neurologic patients // J Neurosurg Anesthesiol 2007, 19:130–135.
- Jacobs S, Hunt R, Tarnow-Mordi W, et al. Cooling for newborns with hypoxic ischaemic encephalopathy // Cochrane Database Syst Rev. 2007, 17(4):CD003311.
- Jiang JY Clinical study of mild hypothermia treatment for severe traumatic brain injury // Journal of Neurotrauma, 2009, 26:399-406.
- Kim F, Olsufka M, Carlbom D, et al: Pilot study of rapid infusion of 2 L of 4°C normal saline for induction of mild hypothermia in hospitalized, comatose survivors of out-of-hospital cardiac arrest // Circulation 2005, 112:715–719.
- Kilpatrick MM, Lowry DW, Firlik AD, et al. Hyperthermia in the neurosurgical intensive care unit // Neurosurgery 2000; 47: 850–855.
- Linares G, Mayer SA. Hypothermia for the treatment of ischemic and hemorrhagic stroke // Crit Care Med, 2009, 37(7): S243-S249
- Marion D, Bullock MR. Current and future role of therapeutic hypothermia // Journal of Neurotrauma, 2009, 26:455-467.
- Pichon N, Amiel JB, Francois B, et al: Efficacy of and tolerance of mild induced hypothermia after out-of-hospital cardiac arrest using an endovascular cooling system // Crit Care 2007, 11:R71.
- Polderman KS. Application of therapeutic hypothermia in the ICU: opportunities and pitfalls of a promising treatment modality. Part 1: Indications and evidence //Intensive care med, 2004, 30(4): 556-575.
- Polderman KS. Application of therapeutic hypothermia in the intensive care unit : Opportunities and pitfalls of a promising treatment modality—Part 2: Practical aspects and side effects // Intensive care med, 2004, 30(5): 757-769.26. Polderman KH, Rijnsburger ER, Peerdeman SM, et al: Induction of hypothermia in patients with various types of neurological injury with use of large volumes of ice-cold intravenous fluid // Crit Care Med 2005, 33:2744–2751.
- Popugaev KA,Savin IA, Goriachev AS, et al. Bedside Positioning Test for Making Decision about Decompressive Hemicraniectomy during Hypothermia in Patient with Malignant Intracranial Hypertension // Crit Care Med 2009, suppl to Vol 37 (12) Reported in 39th congress of CCM in Miami.
- Sagalyn E, Band RA, Gaieski DF Therapeutic hypothermia after cardiac arrest in clinical practice: Review and compilation of recent experiences // Crit Care Med 2009;37: S223-S226.
- Seder DB, Van der Kloot, Thomas E. Methods of cooling: Practical aspects of therapeutic temperature management // Crit Care Med, 2009, 37(7): S211-S222.
- Schmutzhard E, Engelhardt K, Beer R, et al: Safety and efficacy of a novel intravascular cooling device to control body temperature in neurologic intensive care patients: A prospective pilot study // Crit Care Med 2002, 30:2481–2488.
- Schwab S, Mayer SA: Feasibility and safety of moderate hypothermia after massive hemispheric infarction // Stroke 2001, 32:2033–2035.
- Shankaran S. Neonatal encephalopathy: treatment with hypothermia // Journal of Neurotrauma, 2009, 26:437-443.
- Simosa HF, Petersen DJ, Agarwal SK, et al: Increased risk for deep venous thrombosis with endovascular cooling in patients with traumatic head injury // Am Surg 2007, 73:461–464.
- Stocchetti N, Rossi S, Zanier ER, et al Pyrexia in head-injured patients admitted to intensive care // Intensive Care Med. 2002; 28(11):1555-62.
- Van Breda EJ, Van der Worp HB, Van Gemert HMA. PAIS: paracetamol (acetaminophen) in stroke; protocol for a randomized, double blind clinical trial // BMC Cardiovasc Disord. 2005, 5(24).
- Venkatesh A, Diringer MN. Cool Gard/Cool Line™ catheter system // Neurocrit care, 2004, 1(2):209-211.






