НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
Резюме
Приведено описание редкого клинического наблюдения проградиентного развития нарастающей общемозговой неврологической симптоматики, вплоть до развития коматозного состояния, у ребенка с экстра-интравентрикулярной краниофарингеомой в отдаленном послеоперационном периоде, обусловленное развитием бессудорожного эпилептического статуса, который удалось диагностировать только благодаря мониторингу электроэнцефалограммы. В связи с приводимым клиническим наблюдением обсуждается генез бессудорожного эпистатуса и его возможная роль в развитии тяжелого состояния у больных с различной нейрохирургической патологией в послеоперационном периоде.
Введение
Поврежденная ткань головного мозга после нейрохирургических вмешательств может являться причиной формирования очага патологической электрической активности клеток мозга, как правило, проявляющейся различными вариантами судорожных припадков. Частота этого осложнения нейрохирургических вмешательств достигает 5% - 17%, в зависимости от локализации новообразования [23]. Доминирующими в этом отношении являются кортикальные или оболочечные поражения, а основным проявлением этого состояния являются фокальные или генерализованные эпиприпадки. Однако в определенной ситуации патологическая электрическая активность клеток мозга может протекать без характерных клонико-тонических мышечных реакций и реализуется бессудорожным приступом или бессудорожным эпилептическим статусом [49]. Асимптомный эпилептический приступ (т.е. без внешних судорожных проявлений) и, в особенности, эпилептический статус, могут быть причиной нарастания общемозговой и очаговой неврологической симптоматики, вплоть до развития коматозного состояния. В такой ситуации при отсроченном назначении противосудорожных препаратов, что высоко вероятно при бессудорожном приступе, возможно формирование стойкого эпилептогенного очага, который приводит в итоге к гибели нейронов и тяжелому вторичному повреждению мозга [23]. Трудности корректной диагностики таких состояний вполне очевидны.
Приводимое нами клиническое наблюдение в полной мере демонстрирует сложности диагностики и терапии асимптомного эпилептического приступа, который в нашем наблюдении развился у ребенка после повторного удаления краниофарингиомы.
Клиническое наблюдение
Ребенок Т. 6 лет, впервые был госпитализирован в Институт нейрохирургии в октябре 2007 года. В клинической картине при этом выявлялась гипертензионная симптоматика в виде головной боли, рвоты; хиазмальный синдром со снижением зрения на оба глаза, ожирение 2-3 степени (вес-33 кг при росте 104 см). Произведенная ЯМР томография подтвердила наличие у ребенка экстра-интравентрикулярной краниофарингеомы (Рисунок 1).
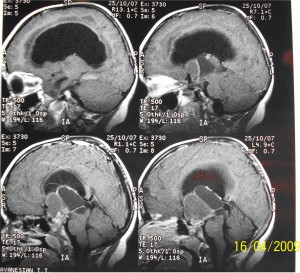
Имеющаяся клиническая симптоматика и данные ЯМР томографии явились показанием для хирургического лечения. В конце октября 2007 года было произведено нейрохирургическое вмешательство – транскраниальное удаление экстра–интравентрикулярной краниофарингиомы. Ребенок хорошо перенес хирургическое вмешательство, но послеоперационный период протекал с осложнениями. Развились гормонально-гомеостатические нарушения в виде несахарного диабета и гипернатриемии. В течение последующих 30 суток послеоперационного периода, на фоне заместительной терапии препаратами ГКС и синтетическими аналогами вазопрессина, удалось компенсировать гормональный дефицит, нормализовать параметры гомеостаза. Состояние ребенка стабилизировалось и он был выписан из стационара. На момент выписки, по данным КТ, выявлялись незначительные по объему не удаленные петрификаты и киста опухоли, расположенные ретрохиазмально, а также небольшое количество ликвора субдурально (Рисунок 2).
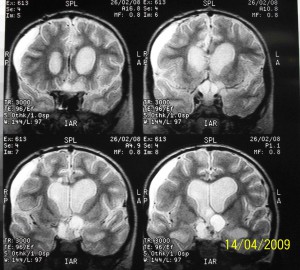
В конце февраля 2008 года (через 4 месяца после первой операции) состояние ребенка ухудшилось. Развились мотивационные нарушения, он стал сонлив, перестал ходить, снизилось зрение, отмечались эпизоды гипертермии до 39ºС. При повторной ЯМР томографии были выявлены наличие субдуральной гидромы, компремирующей правую лобную долю и увеличение размеров кистозной и солидной части краниофарингиомы (Рисунок 3).
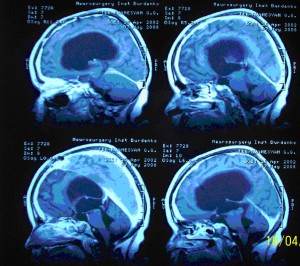
Клинико-рентгенологические данные послужили поводом для повторной госпитализации в ИНХ. После соответствующей предоперационной подготовки ребенку была произведена повторная операция: Удаление краниофарингиомы интра–экстра–вентрикулярной локализации. Была выполнена костнопластическая трепанация в правой лобно-височной области. Под оболочкой располагалась больших размеров гидрома (старая организовавшаяся субдуральная гематома), которая была опорожнена. Быль осуществлен субфронтальный доступ к хиазмально–селлярной области. Позади сонной артерии определялась опухоль с кистой, которая была вскрыта и опорожнена. Основная масса опухоли представляла собой плотную ткань с большим количеством кальцификатов. Постепенно удалось удалить практически всю опухоль, которая располагалась над турецким седлом, и была сращена с остатками ножки гипофиза. Солидной частью опухоль врастала в третий желудочек, инфильтрируя его дно и хиазму зрительных нервов. Постепенно и этот фрагмент был удален.
В раннем послеоперационном периоде отмечалось улучшение общего состояния ребенка. Он стал активнее (сидел, ходил), возрос уровень спонтанной двигательной активности, частично регрессировали мотивационные нарушения. Однако, через 3 недели после операции (в этот период ребенок уже находился в детском нейрохирургическом отделении института) его состояние внезапно ухудшилось. Снизилась произвольная активность, появились выраженные вегетативные пароксизмы, проявляющиеся покраснением кожи, потоотделением, тахикардией до 200, тахипноэ. Эти пароксизмы развивались остро и спонтанно разрешались, длительность их составляла всего несколько минут. Далее, в течение последующих трех суток, присоединились эпизоды повышения мышечного тонуса по типу децеребрационной ригидности, которые развивались на фоне вегетативных пароксизмов. Значимого терапевтического эффекта при использовании диазепама в момент развития описанных пароксизмов отмечено не было.
На 27 сутки после повторной операции, в связи с нарастанием общемозговой симптоматики, формированием устойчивого сопорозного состояния, ребенок был переведен в отделение реанимации. Стали развиваться эпизоды дыхательной недостаточности в виде тахипноэ, поверхостного дыхания, десатурация до уровня SpO2 85%, что явилось основанием для проведения интубации трахеи и респираторной поддержки (ИВЛ в режиме вспомогательной вентиляции с поддержкой давлением спонтанных вдохов).
Несмотря на проводимую терапию, состояние ребенка продолжало ухудшаться. Развилось коматозное состояние, нарос орально-стволовый синдром, участились вегетативные реакции, сопровождающиеся эпизодами децеребрационной ригидности, появился мелкоразмашистый тремор в конечностях (больше в левой руке). Эти пароксизмы не купировались внутривенным введением реланиума (10 мг). На фоне нарастания частоты и выраженности этих пароксизмов в вечерние и ночные часы дежурным реаниматологом был назначен Депакин–хроно в дозе 300 мг/сутки, поскольку двигательные пароксизмы в виде тремора стали напоминать судорожные припадки клонического характера.
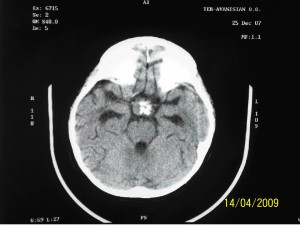
На следующие сутки, утром была произведена запись ЭЭГ в течение 10 минут. Была выявлена дезорганизация корковой ритмики, но типичной эпилептиформной активности зарегистрировано не было, на основании чего Депакин-хроно был отменен. Было выполнено контрольное КТ исследование головного мозга, которое выявило увеличение размеров желудочков (Рисунок 4), в связи, с чем было произведено наружное дренирование правого бокового желудочка, начат мониторинг внутрижелудочкового ликворного давления (ВЛД).
ВЛД в ходе мониторинга периодически достигало 12 - 16 мм.рт.ст., оставаясь преимущественно в пределах 4-10 мм. рт. ст. Учитывая расширение желудочковой системы мозга и кратковременные эпизоды повышения ВЛД было решено имплантировать ребенку вентрикулоперитонеальный шунт с помпой низкого давления, операция прошла без осложнений. Таким образом, был исключен фактор нарушения ликвороциркуляции и повышения ВЧД, как причины тяжелого состояния ребенка. В этот период сохранялись только умеренно выраженные электролитные нарушения в виде гипернатриемии 147-153 ммоль/л. На 40 сутки после операции в связи с сохраняющимся коматозным состоянием, была произведена трахеостомия, через которую и была продолжена ИВЛ во вспомогательном режиме.
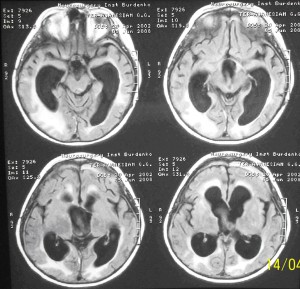
В течение последующих двух недель состояние ребенка оставалось стабильно тяжелым: сохранялось коматозное состояние, периодически возникали вегетативные пароксизмы в виде тахипноэ, тахикардии, гипергидроза, гиперемии кожных покровов, гипертермии до 38-39 ºС. Для исключения инфекционно-воспалительных осложнений были проведены посевы ликвора, крови, мочи, выполнена рентгенография легких – патологических изменений выявлено не было. Системные маркеры воспаления оставались в пределах нормы: общее количество лейкоцитов в клиническом анализе крови – 7х10 9 /л; отсутствовал палочко-ядерный сдвиг; CRP – 2,4 мг/л, прокальцитонин – 0,1 нг/мл.; цитоз ликвора - 5/3; уровень белка в ликворе - 0,41%%. Водно–электролитные нарушения, протекавшие по типу несахарного диабета, в этот период удалось компенсировать на фоне использования минирина (0,2 мг/сут), что позволило удерживать Nа в крови в пределах 143-145 ммоль/л. Глюкоза крови оставляла 5,4 ммоль/л. Температура тела колебалась от нормальной до фебрильной. Было выполнено контрольное КТ исследование головного мозга, которое исключило нарастание гидроцефалии, дисфункцию шунтирующей системы, энцефалит (Рисунок 5).
Причина коматозного состояния по-прежнему оставалась неясной, поэтому было принято решение о проведении ЭЭГ мониторинга (исследование в течение 2 – 3 часов), так как этот вариант ЭЭГ исследования обладает максимальной информативностью при различных вариантах судорожных состояний [9]. По результатам ЭЭГ мониторинга, была выявлена продолженная (в виде электрического статуса!) эпилептиформная активность в лобно–височных отведениях справа (Рисунок 6).
На основании этих результатов была назначена противосудорожная терапия: Депакин–хроно 1000 мг/сутки и клоназепам 1 мг/сутки. В течение последующей недели на фоне проводимой терапии, регрессировали пароксизмы двигательные в виде тремора и вегетативные. Через две недели у ребенка появилось спонтанное открывание глаз и фиксация взора. На фоне повышения уровня бодрствования была прекращена ИВЛ, пациент был переведен на самостоятельное дыхание. На 70 сутки после операции, на фоне значительного улучшения состояния, ребенок был переведен в хирургическое отделение, где была начата активная реабилитационная терапия.
Повторный ЭЭГ мониторинг, проведенный через 14 суток после первого продленного исследования и начала эффективной противосудорожной терапии, выявил редукцию эпилептиформной активности и появление физиологических паттернов, что подтвердило адекватность проводимой терапии (Рисунок 7).
Ребенок был выписан из стационара на 90 сутки после операции (через 2 месяца после начала адекватной противосудорожной терапии). При контрольном ЭЭГ исследовании при выписке эпилептиформной активности не выявлялось (Рисунок 8).
Обсуждение
В приведенном наблюдении мы столкнулись с относительно редкой клинической ситуацией - отсроченным от момента операции нарастанием неврологической симптоматики, вызванным бессудорожным эпистатусом, развившемся у ребенка после удаления краниофарингиомы. В целом осложнения в послеоперационном периоде после удаления краниофарингиом развиваются в 10 - 14% наблюдений, и, прежде всего, связаны с непосредственным повреждением диэнцефальных структур. Они включают в себя сомноленцию, появление подкорковых и орально-стволовых синдромов, выраженные мотивационные, гормонально-гомеостатические, водно–электролитные, терморегуляционные нарушения. По данным Broggi [10], эпилептические приступы в послеоперационном периоде после удаления краниофарингиом выявляются только в 6% наблюдений. В доступной литературе нам удалось найти сообщения о развитии бессудорожных эпиприступов у пострадавших с черепно-мозговой травмой [3;54], у больных, перенесших спонтанное субарахноидальное кровоизлияние [3;35], после удаления опухолей головного мозга и, в частности, краниофарингиом [1]. Остановимся на этом феномене более подробно.
Впервые понятие неконвульсивного эпилептического статуса (НЭС) было введено Celesia в 1976 году [12]. За более чем 30 летний период существования понятия НЭС можно отметить разные моменты отношения к нему: от тотального увлечения [5;26-28;34;38], до настороженного отношения и даже его полного отрицания [8;18;30;41;46;48]. Однако, что же такое НЭС? Наиболее разумным определением НЭС нам представляется следующее, предложенное Epilepsy Reseach Foundation Workshop [56], которое сводится к трем основным моментам:
- Клинически выявляемые изменения уровня сознания или другие эквиваленты;
- Наличие характерных спайковых проявлений, выявляемых при проведении ЭЭГ мониторинга;
- Положительный эффект от проводимой терапии антиконвульсантами в виде нормализации ЭЭГ и исчезновения клинической симптоматики.
Третий пункт определения признается не всеми исследователями, но нам он представляется достаточно важным.
Вопрос о частоте встречаемости НЭС крайне сложен и здесь можно согласиться лишь с тем, что объективные данные по этому вопросу получить крайне сложно [2;7;8;18;24;27-30;37;39;47;50]. Разные авторы приводят различные цифры: от 7,8 – 10,5 до 65 и даже 89 % в исследуемых сериях больных. Очевидно, что эта цифра зависит не только от использованных методов диагностики, но и от контингента больных. Понятно, что среди больных с церебральным повреждением частота встречаемости НЭС должна быть намного выше, по сравнению с больными с другой патологией. В целом этот вопрос следует признать в настоящее время до конца неизученным.
Причины развития НЭС до сих пор так же не вполне понятны. Его развитие описано при целом ряде самых различных клинических состояний, манипуляций и использовании фармакологических препаратов: хирургия опухолей основания черепа [1], церебральная ангиография [55], применение цефалоспоринов [21;36;45;52;53], теофеллина [42], солей лития [31], фосфамида [32], тиагабина [25;28;33], карбамазепина [40], черепно-мозговой травме [54], проведении хронического гемо- [24] и перитонеального диализа [13], болезни Крейцфельда-Якоба [14;51], спонтанных субарахноидальных и интравентрикулярных кровоизлияниях [16;20;35], склерозирующем энцефалите [4], аномалиях развития мозга [57], герпетическом энцефалите [22], некротизирующем лейкоэнцефалите [19], при ВИЧ инфекции [15], метастазах в головной мозг [6], после электросудорожной терапии [44] и височной лобэктомии [11;17], и наконец, просто после отмены приема бензодиазепинов [43]. Возможно, перечень этих причин развития НЭС даже не является полным, но и в имеющемся виде он впечатляет и наводит на мысль о неспецифичности НЭС. Однако, это, по-видимому, предмет дальнейших исследований.
Возникновение в послеоперационном периоде у нашего больного вегетативных пароксизмов, сопровождающихся позно–тоническими реакциями, отсутствие патологической активности при кратковременной регистрации ЭЭГ, наличие гормональных, водно – электролитных нарушений, позволило предположить диэнцефальную природу угнетения уровня бодрствования. Однако, несмотря на коррекцию эндокринно-метаболических нарушений, неврологическая симптоматика только усугублялась. У пациента сформировалось коматозное состояние при сохранении пароксизмальной симптоматики. Проведенные диагностические мероприятия (прежде всего нейровизуализация) не выявили причины прогрессирующего нарастания неврологической симптоматики.
Анализ литературы позволил посмотреть на данную клиническую ситуацию под другим углом. По данным целого ряда исследователей [5] у пациентов в бессознательных состояниях, находящихся в отделениях нейрореанимации, сопутствующие бессудорожные эпиприступы выявляются с частотой от 8% до 80 %. Опираясь на эти данные в приводимом клиническом наблюдении нами был осуществлен ЭЭГ мониторинг, который выявил наличие электрического статуса - эпилептиформную активность, не зарегистрированную при кратковременной записи ЭЭГ. Назначение адекватной противосудорожной терапии привело к регрессу двигательных, вегетативных пароксизмов и повышению уровня бодрствования, восстановлению сознания, с возможностью проведения последующей двигательной реабилитации и выпиской из стационара.
Следует отметить, что из всех многочисленных описаний клинических наблюдений. Наиболее близкой к нашей ситуации оказалась серия из семи клинических наблюдений, опубликованная Al-Mefty и соавторами в Journal of Neurosurgery в 2009 году [1]. Остановимся на этой работе подробнее. Из своего клинического опыта авторам удалось извлечь семь пациентов, всех женщин, которые были оперированы супратенториально по поводу различной базальной патологии (только в одном наблюдении это была краниофарингеома, как и в нашем наблюдении), при средней продолжительности операции 9 +/- 2 часа и без исходных нарушений на ЭЭГ, у которых в сроки от 8 часов до 13 суток после операции развилось постепенное ухудшение неврологической симптоматики, вплоть до развития коматозного состояния без признаков появления очаговой неврологической симптоматики. Весь комплекс нейровизуализации включая КТ, МРТ, диффузию/перфузию, ЯМР ангиографию не выявил какой либо патологии. ТКД, использованная для диагностики вазоспазма как возможной причины коматозного состояния, не выявила каких либо отклонений. И только 24 часовое мониторирование ЭЭГ диагностировало наличие патологической судорожной активности без внешних судорожных проявлений. Всем больным была назначена комплексная противосудорожная терапия, которая включала в себя: фенитоин, карбамазепин, фенобарбитал, вальпроевую кислоту, леветерацитам и топиромат. Каждый из пациентов получал комбинацию 2 – 3 антиконвульсантов одномоментно. Продолжительность коматозного состояния на фоне этой терапии колебалась от 1 до 26 дней. Следует отдать должное авторам, они достаточно четко отсекли такие причины как морфологические и метаболические нарушения, включая депривацию алкоголя. Но в обсуждении причин состояния они рассмотрели несколько причин: 1. Анестетики, 2. Фентанил, 3. Антибиотики (прежде всего цефалоспорины). За исключением цефалоспоринов [45;52] все объяснения выглядят малоубедительными. Но импонирует предлагаемый авторами подход: мы имеем дело с необычной и крайне интересной клинической ситуацией (авторы даже предлагают выделение ее в виде специфического синдрома), в которой многочасовой мониторинг ЭЭГ позволяет выявить специфические паттерны нарушения, а назначение эффективной противосудорожной терапии позволило добиться 100 % выздоровления.
Заключение
В приведенном наблюдении клинически скрытая эпилептическая активность (неконвульсивный эпилептический статус, или электрический статус) явилась причиной коматозного состояния, которое и было основным клиническим проявлением эпилептического статуса у нашего пациента. Только назначение адекватной противосудорожной терапии позволило восстановить нормальный уровень бодрствования у ребенка, а затем и благополучно выписать его из клиники. В связи с приведенным выше клиническим наблюдением, мы считаем, что использование ЭЭГ мониторинга, даже в течение 1 – 2 часов, обосновано у всех пациентов, находящихся в отделении нейрореанимации в бессознательном состоянии после удаления опухолей мозга и других тяжелых церебральных катастроф, таких как ЧМТ, аневризматические САК или нейроинфекции.
Литература
- Al-Mefty O., Wrubel D., Haddad N. Postoperative nonconvulsive encephalopathic status: identification of syndrome responsible for dekayed progressive deterioration of neurological status after skull base surgery.// J. Neurosurg. 2009. PMID: 19326988 (electronic publication).
- Abend N.S., Dlugos D.J. Nonconvulsive status epilepticus in a pediatric intensive care unit.// Pediatr. Neurol. 2007 V. 37 p. 165 – 170.
- Amantini A., Fossi S., Grippo A., et al. Continuous EEG – SEP monitoring in severe brain injury.// Neurophysiol. Clin. 2009. V. 39 p. 85 – 93.
- Aydin O.F., Senbil N., Gurer Y.K. Nonconvulsive status epilepticus on EEG in a case with subacute sclerosing panencephalitis.// J. Child. Neurol/ 2006. V. 21 p. 256 – 260.
- Beltran S., Jacobs T. An excitatory path to unconsciousness: Nonconvulsive status epilepticus.// Int. Anesth. Clin. 2008. V. 46 p. 159 – 170.
- Blitcshteyn S., Jaeckle K.A. Nonconvulsive status epilepticus in metastatic CNS disease.// Neurology. 2006. V. 66 p. 1261 – 1263.
- Bearden S., Eisenschenk S., Uthman B. Diagnosis of nonconvulsive status epilepticus (NCSE) in adult with altered mental status: clinic-EEG considerations.// Am. J. Electroneurodiagnostic Technol. 2008. V. 48 p. 11 – 37.
- Brenner R.P. Is it status?// Epilepsia. 2002. V. 43 Suppl. 3. P. 103 – 113.
- Brenner R.P. EEG in convulsive and nonconvulsive status epilepticus.// J. Clin. Neurophysiol. 2004. V. 21 p. 319 – 331.
- Broggi G. (Ed) Craniopharyngioma. Surgical Management of Craniopharyngiomas from 1976 to 1992. Problems and Results. Springer. Milano etc. 1995. p. 73 - 86.
- Burneo J.G., Steven D., McLachlan R.S. Nonconvulsive status epilepticus after temporal lobectomy.// Epilepsia. 2006. V. 46 p. 1325 – 1327.12. Celesia G.G. Modern concepts of status epilepticus.// JAMA. 1976. V. 235 p. 1571 – 1574.
- Chow K.M., Wang A.Y., Hui A.C., et al. Nonconvulsive status epilepticus in peritoneal dialysis patients.// Am. J. Kidney Dis. 2001. V. 38 p. 400 – 405.
- Cohen D., Kutluay E., Edwards J., et al. Sporadic Creutzfeldt-Jakob disease presented with nonconvulsive status epilepticus.// Epilepsy Behav. 2004. V. 5 p. 792 – 796.
- Cure R.F., Wichert-Ana L., Sakamoto A.C., et al. Focal nonconvulsive status epilepticus associated to PLEDs and intense focal hyperemia in an AIDS patients.// Seizure. 2004. V. 13 p. 358 – 361. 16.Dennis L.J., Chaassen J., Hirsch J., et al. Nonconvulsive status epilepticus after subarachnoid hemorrhage.// Neurosurgery. 2002. V. 51 p. 1136 – 1144.
- Dietl T., Urbach H., Helmstaedter C., et al. Persistent severe amnesia due to seizure recurrence after unilateral temporal lobectomy.// Epilepsy Behav. 2004. V. 5 p. 394 – 400.
- Drislane F.W. Presentation, evaluation, and treatment of nonconvulsive status epilepticus.// Epilepsy Behav. 2000. V. 1 p. 301 – 314.
- Fernandez-Torre J.L., Arce F., Martinez-Martinez M., et al. Necrotizing leukoencephalophaty associated with nonconvulsive status epilepticus and periodic short-interval diffuse disscharges: a clinicopathological study.// Clin. EEG. Neurosci. 2006. V. 37 p. 50 – 53.
- Fernandez-Torre J.L., Aqiore Z., Puchades R., et al. Nonconvulsive status epilepticus causing prolonged stupor after intraventricular hemorrhage: report a case.// Clin. EEG Neurosci. 2007. V. 38 p. 57 – 60.
- Grill M.F., Maganti R. Cephalosporin-induced neurotoxocity: clinical manifestations, potential pathogenic mechanisms, and the role of EEG monitoring.// Ann. Pharmacother. 2008. V. 42 p. 1843 – 1850.
- Gunduz A., Beskardes A.F., Kutlu A., et al. Herpes encephalitis as a cause of nonconvulsive status epilepticus.// Epileptic Disord. 2006. V. 8 p. 57 – 60.
- Hirsch J., et al. Nonconvulsive status epilepticus in children: clinical and EEG cyaracteristics. In: Epilepsia. Columbia Univ. NY. 2006. p. 1504 – 1509.
- Iftikhar S., Dahbour S., Nauman S. Nonconvulsive status epilepticus: high incidence in dialysis-dependent patients.// Hemodial. Int. 2007. V. 11 p. 392 – 397.
- Imperiale D., Pignatta P., Cerrato P., et al. Nonconvulsive status epilepticus due to a de novo contralateral focus during tiagabine adjunctive therapy.// Seizure. 2003. V. 12 p. 319 – 322.
- Inoue Y., Fujiwara T., Matsuda K., et al. Ring chromosome 20 and nonconvulsive epilepticus. A new epileptic syndrome.// Brain. 1997. V. 120 p. 939 – 953.
- Jagoda A. Nonconvulsive seizures.// Emerg. Med. Clin. N. Am. 1994. V. 12 p. 963 – 971.
- Jette N., Claassen J., Emerson R.G., Hirsch L.J. Frequency and predictors of nonconvulsive seizures during continuous EEG monitoring in critically ill children.// Arch. Neurol. 2006. V. 63 p. 1750 – 1755.
- Kaplan P.W. Prognosis in nonconvulsive status epilepticus.// Epileptic Disord. 2000. V. 2 p. 185 – 194.
- Kaplan P.W. The clinical features, diagnosis, and prognosis of nonconvulsive status epilepticus.// Neurologist. 2005. V. 11 p. 348 – 361.
- Kaplan P.W., Birbeck G. Lithium-induced confusional states: nonconvulsive status epilepticus or triphasic encephalopathy?// Epilepsia. 2006. V. 47 p. 2071 – 2074.
- Kilickap S., Cakar M., Jneil I.K., et al. Nonconvulsive status epilepticus due to ifosfamide.// Ann. Pharmacother. 2006. V. 40 p. 332 – 335.
- Koepp M.J., Edwards M., Collins J., et al. Status epilepticus and tiagabine therapy revisited.// Epilepsia. 2005. V. 46 p. 1625 – 1632.
- Korff C.M., Nordli D.R.Jr. Diagnosis and management of nonconvulsive status epilepticus in children.// Neurology. 2007. V. 3 p. 505 – 516.
- Little A.S., Kerrigan J.F., McDougall C.G., et al. Nonconvulsive status epilepticus in patients suffering spontaneous subarachnoid hemorrhage.// J. Neurosurg. 2007. V. 106 p. 805 – 811.
- Maganti R., Jolin D., Rishi D., et al. Nonconvulsive status epilepticus due to cefepime in a patient normal renal function.// Epilepsy behave. 2006. V. 8 p. 312 – 314.
- Maganti R., Gerber P., Drees C., et al. Nonconvulsive status epilepticus.// Epilepsy Behav. 2008. V. 12 p. 572 – 586.
- Murthy J.M. Nonconvulsive status epilepticus: An under diagnosed and potentially treatable condition.// Neurol. India. 2003. V. 51 p. 453 – 454.
- Narayamam J.T., Murthy J.M. Nonconvulsive status epilepticus in a neurological intensive care unit: profile in a developing country.// Epilepsia. 2007. V. 48 p. 900 – 906.
- Marini C., Parmeggiani L., Masi G., et al. Nonconvulsive status epilepticus precipitated by carbamazepine presenting as dissociative and affective disorders in adolescents.// J. Child. Neurol. 2005. V. 20 p. 693 – 696.
- Niedermeyer E., Ribeiro M. Considerations of nonconvulsive status epilepticus.// Clin. Electroencephalogr. 2000. V. 31 p. 192 – 195.
- Nobutoki T., Nakahashi J.Y., Ihara T. [A 5-year-old boy with nonconvulsive status epilepticus induced by theophyline treatment.]// No To Hattatsu. 2008. V. 40 p. 328 – 332.
- Olues M.J., Golding A., Kaplan P.W. Nonconwulsive status epilepticus resulting from benzodiazepine withdrawal.// Ann. Intern. Med. 2003. V. 139 p. 956 – 958.
- Povlsen U.J., Wildschiodtz G., Hogenhaven H., et al. Nonconvulsive status epilepticus after electroconvulsive therapy.// J. ECT. 2003. V. 19 p. 164 – 169.
- Primavera A., Cocito L., Audenio D. Nonconvulsive status epilepticus during cephalosporine theraphy.// Neuropsyhobiology. 2004. V. 49 p. 218 – 222.
- Riggio S. Nonconvulsive status epilepticus: clinical features and diagnostic challenges.// Psych. Clin. N. Am. 2005. V. 28 p. 653 – 664.
- Rosenow F., Hamer H.M., Knake S. The epidemiology of convulsive and nonconvulsive status epilepticus.// Epilepsia. 2007. V. 48 p. 82 – 84. 48.Ruegg S., Dichter M.A. Diagnosis and treatment of nonconvulsive status epilepticus in an intensive care unit setting.// Curr. Treat. Opinions Neurol. 2003. V. 5 p. 93 – 110.
- Rüegg S. Non-convulsive status epilepticus in adults – an overview.// J. Neurol. Neurosurg. Psych. 2008. V. 29 p. 545 – 555.
- Saenqpattrachai M., Sharma R., Hunjan A., et al. Nonconvulsive seizures in the pediatric intensive care unit: etiology, EEG, and brain imaging findings.// Epilepsia. 2006. V. 47 p. 1510 – 1518.
- Shapiro J.M., Shyaat A., Wang J., et al. Creutzfeld-Jakob disease presenting as refractory nonconvulsive status epileptic.// J. Intensive Care Med. 2004. V. 19 p. 345 – 348.
- Thabet F., Al Maghrabi M., Al Barraq A., et al. Cefepime-induced nonconvulsive status epilepticus: case report and review.// Neurocrit. Care. 2009. V. 10 p. 347 – 351.
- Vannaprasaht S., Tavalee A., Mayurasakorn N., et al. Ceftazidime overdose-related nonconvulsive status epilepticus after intraperitoneal instillation.// Clin. Noxicol. 2006. V. 44 p. 383 – 386.
- Vespa P.M., Miller C., McArthur D., et al. Nonconvulsive electrographic seizures after traumatic brain injury result in a delayed prolonged increase in ICP and metabolic crisis.// Crit. Care Med. 2007. V. 35 p. 2830 – 2836.
- Vickrey B.G., Bahls F.H. Nonconvulsive status epilepticus following cerebral angiography.// Ann. Neurol. 1989. V. 25 p. 199 – 201.
- Walker M., Cross H., Smith S., et al. Nonconvulsive status epilepticus: Epilepsy Research Foundation Workshop Reports.// Epileptic Disord. 2005. V. 7 p. 253 – 296.
- Wright H., Hardlaw J., Young A.W., et al. Prosopagnosia following nonconvulsive status epilepticus associated with a left fusiform gyrus malformation.// Epilepsy Behav. 2006. V. 9 p. 197 – 203.






